
Naturstoffbiosynthesewege in Pflanzen und Einzelzellen
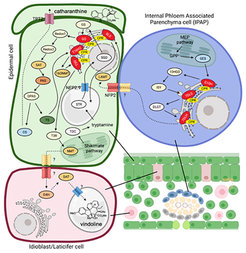
Naturstoffe werden über komplexe Stoffwechselwege durch die aufeinanderfolgende Wirkung spezieller Enzyme synthetisiert, die sich in verschiedenen Zellkompartimenten und in unterschiedlichen Zelltypen befinden. Die korrekte Zusammensetzung der Endprodukte erfordert daher eine hochgradig koordinierte Wirkung von Enzymen, Transportern und akzessorischen Proteinen in den verschiedenen Zelltypen des Gewebes.
Um diese komplexen Prozesse zu verstehen, implementieren und adaptieren wir die neuesten Einzelzell-"Omics"-Sequenzierungstechnologien für die Analyse unserer Pflanzen von Interesse. Außerdem entwickeln wir massenspektrometrische Methoden für die gezielte und ungezielte Analyse von pflanzlichen Naturstoffen in Einzelzellen. Wir wenden diese neuen Ansätze derzeit an, um offene Fragen der Alkaloidbiosynthese zu beantworten.
Biosynthese von Vinblastin in Catharanthus roseus
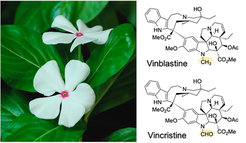
Die Heilpflanze Catharanthus roseus (Madagaskar-Immergrün) gilt als Geschenk Afrikas an die Menschheit, da sie die einzige Quelle für zwei Krebsmedikamente, Vinblastin und Vincristin, ist, die seit mehr als 60 Jahren verwendet werden. Die Biosynthese dieser dimeren Metaboliten, die Bisindole genannt werden, erfordert mehr als 30 chemische Reaktionen, von denen die meisten in den letzten drei Jahrzehnten aufgeklärt wurden. Diese Chemikalien entstehen aus der Dimerisierung von zwei Monoterpenindolalkaloiden (MIA), Catharanthin und Tabersonin. Der Mechanismus der Dimerisierung und der weiteren Derivatisierung des Kopplungsprodukts ist jedoch noch unbekannt. Wir verwenden eine Kombination aus Transkriptomik, Metabolomik und Biochemie auf Gewebe- und Zellebene, um die letzten biosynthetischen Schritte bei der Bildung dieser wertvollen Naturstoffe aufzudecken.
Einzelzell-Metabolomik (scMet)
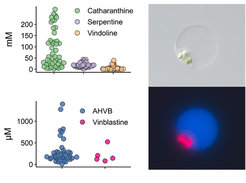
Die Analyse des Stoffwechselprofils einzelner Zellen wird nicht routinemäßig durchgeführt. Den bekannten Methoden mangelt es an Empfindlichkeit und an der Möglichkeit einer strengen strukturellen Identifizierung. Daher haben wir eine Methode für die Einzelzell-Metabolomik (single-cell Metabolomics - scMet) entwickelt, die die Analyse von 180 Zellen/Tag ermöglicht und sowohl qualitative als auch quantitative Daten zu den in jeder Zelle nachgewiesenen Metaboliten liefert. Wir haben diese Methode angewandt, um viele Klassen von Naturstoffen aus einzelnen Zellen von C. roseus und anderen Pflanzen zu quantifizieren. Mit dieser Methode können wir feststellen, in welchen Zelltypen verschiedene biosynthetische Reaktionen ablaufen, den Transport der biosynthetischen Zwischen- und Endprodukte kartieren und schließlich Modelle für die Rolle entwickeln, die die Lokalisierung bei der Steuerung des Pflanzenstoffwechsels spielt. In Kombination mit der Einzelzell-Transkriptomik wird scMet es uns ermöglichen, einige der kryptischsten Stoffwechselschritte in der Biosynthese von Naturstoffen zu erforschen.
Evolution der Aufteilung der Stoffwechselwege
Die Fortschritte in der DNA- und RNA-Sequenzierungstechnologie haben uns Zugang zu Informationen verschafft, um Gene zu identifizieren, die an der Biosynthese von Naturprodukten beteiligt sind. In der Regel vergleichen wir das Transkriptom der Massen-RNA und die Metabolitenanalyse verschiedener Pflanzen, um unterschiedlich exprimierte Gene zu identifizieren, die mit unterschiedlichen Metabolitengehalten in den Geweben korreliert sind. Dieser Ansatz ist zwar effektiv, aber nicht effizient, da Hunderte von Genen durchsucht werden müssen, bevor das richtige gefunden wird.
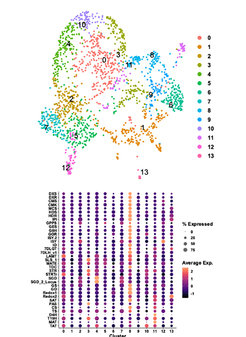
Die jüngste Anwendung von Einzelzell-RNA-Sequenzierungsmethoden auf Pflanzen verändert die Landschaft der Pflanzengenentdeckung. Daher bauen wir Pipelines zur Generierung eigener Einzelzell-Transkriptomdaten auf und entwickeln Methoden zur tieferen Sequenzierung einzelner Zellen von Interesse. Diese Datensätze werden die Identifizierung von Genen für die Naturstoffwege von Interesse erleichtern. Darüber hinaus werden diese Datensätze die Entwicklung der Zelltypspezifität aufzeigen und zeigen, ob die Aufteilung spezifischer Biosynthesewege zwischen verschiedenen Zelltypen in verwandten Pflanzen konserviert ist.
Transport von Metaboliten bei der Alkaloidbiosynthese

Die MIA-Biosynthese in C. roseus weist eine ausgeklügelte räumliche Organisation über mindestens drei verschiedene Zelltypen und sieben subzelluläre Orte auf. Diese Kompartimentierung begrenzt die Produktion von Bisindolalkaloiden in C. roseus und stellt eine Herausforderung für ihre Rekonstitution in fremden Wirten dar. Die Mechanismen, die dem Transport von MIAs zugrunde liegen, sind jedoch noch weitgehend unerforscht. Unser Ziel ist die Entdeckung und Charakterisierung der zellulären und subzellulären Membran-Torwächter der MIA-Biosynthese in C. roseus.
Biosynthetisches Potenzial von Pflanzenzellkulturen
Pflanzenzellkulturen werden kommerziell für die kontrollierte Produktion nützlicher Sekundärmetaboliten verwendet. Pflanzenzellkulturen produzieren jedoch häufig wertvolle Verbindungen in geringen Mengen und weisen ein hohes Maß an genetischer und epigenetischer Instabilität auf. Die von uns entwickelten Einzelzellmethoden ermöglichen es uns, die mechanistische Grundlage dieser Instabilität zu entschlüsseln und herauszufinden, wie diese Kulturen für die Produktion hochwertiger Metaboliten, wie z. B. des Krebsmedikaments Vinblastin, manipuliert werden können.





