
Neurophysiologie
Functional Imaging
Wir verwenden sowohl die Weitfeld- als auch die 2-Photonen-Funktionsbildgebung, um die neuronale Aktivität einzelner Neuronen oder ganzer neuronaler Populationen gleichzeitig zu beobachten. Für funktionelle Bildgebungsexperimente in nicht-genetischen Modellorganismen, wie z.B. verschiedenen Mottenarten, baden wir das Insektengehirn mit Calcium-sensitiven Farbstoffen (z.B. Calcium Green-AM) (weitere Informationen finden Sie in den folgenden Papieren: Bisch-Knaden et al. J Exp Biology. 2012; Bisch-Knaden et al. Proc R Soc B. 2014). In Drosophila melanogaster stehen mehrere binäre Transkriptionssysteme zur Verfügung, wie z. B. GAL4-UAS oder LexA-Aop, die wir zur genetischen Expression verschiedener fluoreszierender Calcium-sensitiver Proteine (z. B. Cameleon oder G-CaMP) einsetzen. Je nach Promotorlinie können die Calcium-Sensoren in selektiven neuronalen Populationen wie z.B. olfaktorischen sensorischen Neuronen oder Projektionsneuronen exprimiert werden. Weitere Einzelheiten finden Sie in unserer Übersichtsarbeit über "Calcium Imaging of Neural Activity in Drosophila" (Strutz et al. Neuromethods. 2012).
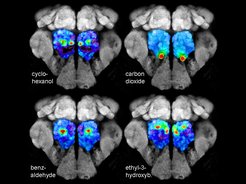
GC-Functional Imaging
Geruchsinformationen werden überwiegend als komplexe Geruchsmischungen wahrgenommen. Um zu analysieren und zu überwachen, wie natürliche Geruchsmischungen kodiert und von den olfaktorischen Schaltkreisen verarbeitet werden, haben wir eine Technik entwickelt, die Gaschromatographie und funktionelle Bildgebung (GC-I) kombiniert. Diese Technik ermöglicht es, die aktiven Geruchskomponenten einer komplexen Mischung zu identifizieren, diese Verbindungen als Stimuli in naturnahen Konzentrationen zu verwenden und geruchsinduzierte Kalziumsignale in selektiven Neuronenpopulationen des Geruchssystems von Insekten zu messen. Die funktionelle GC-I-Technik kann als wertvolle ergänzende Methode zu den klassischen GC/Elektrophysiologie-Techniken angesehen werden und stellt ein äußerst nützliches Instrument zur Untersuchung der chemischen Wechselwirkungen zwischen Insekten und Pflanzen sowie zwischen Insekten und Pflanzen dar.
Patch Clamp
Geruchsrezeptoren in Insekten sind Ionenkanäle, die durch die Bindung von Geruchsmolekülen aktiviert werden. Um die biophysikalischen und pharmakologischen Eigenschaften zu untersuchen, registrieren wir die Ströme, die diese Kanäle passieren, mit der Patch-Clamp-Methode. Dabei handelt es sich um eine elektrophysiologische Technik, mit der winzige Ionenströme durch die Plasmamembran von Zellen oder Membranflecken gemessen werden können. Diese Messungen können mit Riechrezeptorneuronen durchgeführt werden, die diese Rezeptoren endogen exprimieren, oder in Kulturzellen, die mit der rezeptorkodierenden DNA transfiziert sind (Wicher et al. Nature. 2008).
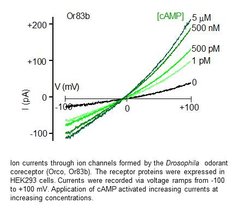
Zellkultur
Zur Expression von Insektengeruchsrezeptoren oder anderen Ionenkanälen verwenden wir kultivierte Zellen wie humane embryonale Nierenzellen (HEK293) oder Ovarialzellen des chinesischen Hamsters (CHO). Zellen, die in einer Schale plattiert werden, werden mit den Plasmiden transfiziert, die die genetische Information tragen, um die Proteine von Interesse zu produzieren (Halty-de Leon et al. J Neurosci Methods. 2016). Die funktionellen Eigenschaften dieser Proteine können mit elektrophysiologischen oder fluoreszenzoptischen Methoden untersucht werden.



