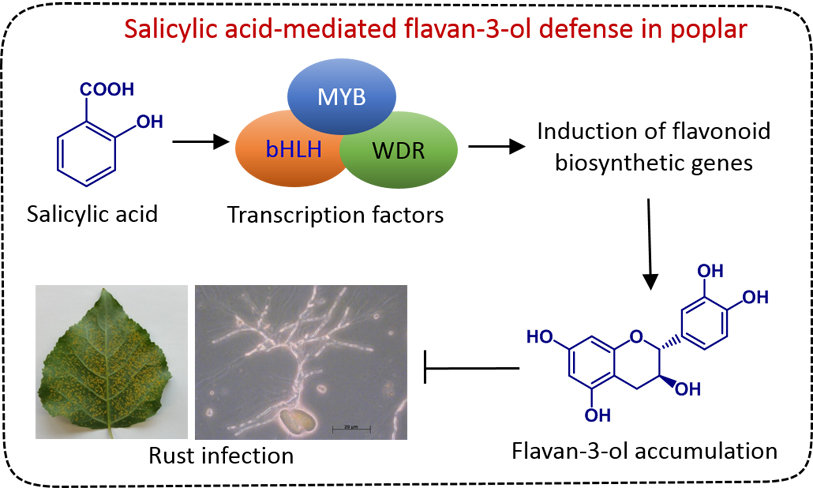
Chemische Ökologie von Wechselwirkungen zwischen Pflanzen und Pathogenen
In der Natur sind Pflanzen einer Vielzahl von schädlichen Krankheitserregern und Umweltbelastungen ausgesetzt. Um diese Herausforderungen zu meistern, verfügen Pflanzen über ausgeklügelte Abwehr- oder Toleranzmechanismen. Jede Pflanzenzelle hat das Potenzial einer angeborenen Immunität und kann schnell und effizient Reaktion Krankheitserreger reagieren. Darüber hinaus können die lokalisierten Immunantworten auch über weite Entfernungen übertragen werden, sodass die gesamte Pflanze gegen nachfolgende Angriffe gut geschützt ist. Kleine Moleküle, die entweder im gesamten Pflanzenreich konserviert sind (z. B. Hormone) oder von bestimmten Pflanzentaxa synthetisiert werden (z. B. spezialisierte Metaboliten), spielen eine wichtige Rolle bei der Pflanzenabwehr. In unserer Gruppe sind wir daran interessiert, die Chemie, Biosynthese, Regulierung und Funktionen verschiedener Klassen von Pflanzenabwehrstoffen zu verstehen. Wir verwenden eine Reihe von analytischen, biochemischen, molekularen und ökologischen Ansätzen, um zu verstehen, wie niedermolekulare Pflanzenmetaboliten das Ergebnis von Wirt-Pathogen-Interaktionen vermitteln, insbesondere bei Pappeln und Reis.

Projekt 1: Biochemie und Signalwirkung von Strigolactonen bei der Interaktion zwischen Pappeln und Krankheitserregern
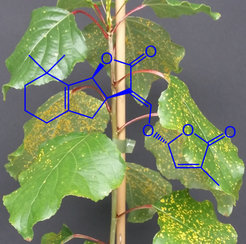
Strigolactone (SLs) sind eine relativ neue Klasse von Terpenoidhormonen, die verschiedene Aspekte der Pflanzenentwicklung und der symbiotischen Wechselwirkungen zwischen Pflanzen und Mikroorganismen regulieren. In der Vergangenheit wurden SLs, die von Wurzeln abgesondert werden, als Keimungsstimulatoren von Samen parasitären Unkrauts identifiziert. Mehr als 25 natürlich vorkommende SLs wurden bereits in verschiedenen ein- und zweikeimblättrigen Pflanzen entdeckt; diese Zahl wird in naher Zukunft wahrscheinlich noch steigen. Ihre strukturelle Vielfalt und die Tatsache, dass SLs nur in sehr geringen Konzentrationen in Pflanzen vorkommen, machen es schwierig, diese Verbindungen zu quantifizieren. Seit ihrer Anerkennung als neue Pflanzenhormone wurden viele Untersuchungen zur Chemie, Biosynthese, Signalwirkung und den Funktionen von SLs in verschiedenen Pflanzenarten durchgeführt. Ihre Rolle bei Interaktionen zwischen Pflanzen und Krankheitserregern bleibt jedoch umstritten. Darüber hinaus ist unser derzeitiges Verständnis der Rolle von SLs in der Biologie von Bäumen weitgehend unbekannt, obwohl die meisten Gene, die an der SL-Biosynthese und -Signalübertragung beteiligt sind, in der Pappel beschrieben wurden. In diesem Projekt sollen die in der Pappel produzierten SL-Strukturen erfasst, die wichtigsten Enzyme charakterisiert, ihre Rolle bei der Abwehr von Krankheitserregern und der Pflanzenentwicklung bestimmt, die möglichen Wechselwirkungen mit anderen Hormonen untersucht und festgestellt werden, ob SLs den Sekundärstoffwechsel regulieren.
Projekt 2: Biosynthese und Funktionen von Caffeoylchinasäuren in Pappeln
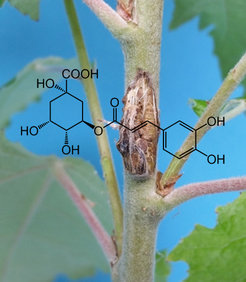
Caffeoylchinasäuren (Caffeoylquinic acids - CQA) sind Ester von Kaffeesäure und Chinasäure, die in vielen Pflanzenarten vorkommen. Diese phenolischen Verbindungen sind Produkte des Ligninstoffwechsels und haben bekanntermaßen verschiedene ökologische Funktionen. Darüber hinaus verringert das Vorhandensein von CQAs in der pflanzlichen Ernährung des Menschen das Risiko für Herz-Kreislauf-Erkrankungen und Krebs. CQAs können sich strukturell durch die Bindungsposition des Chinasäureanteils an den Caffeoyl-Anteil unterscheiden. Von vielen Pflanzen ist beispielsweise bekannt, dass sie 5CQA, 4CQA, 3CQA und 1CQA enthalten. Alle diese Strukturen werden zusammen als Chlorogensäuren bezeichnet. Die Pappel synthetisiert und akkumuliert erhebliche Mengen an 5CQA und 3CQA in Blättern, Rinde und Wurzeln. Wir haben herausgefunden, dass diese Stoffwechselprodukte in Pappelblättern und -stämmen bei Pathogenbefall in unterschiedlicher Weise gebildet werden. Nun stellt sich die Frage, warum Pflanzen mehrere CQAs produzieren? Da wir wissen, dass sie unter verschiedenen Bedingungen induziert werden, haben sie deshalb unterschiedliche Funktionen? Wirken sie als Antioxidantien oder als Prooxidantien? All diese Forschungsfragen machen diese Verbindungen für weitere Untersuchungen äußerst interessant.
Projekt 3: Erforschung der natürlichen Resistenz von Reis gegen Krankheitserreger: ein Fokus auf terpenoiden Phytoalexinen und ihrer hormonellen Regulierung
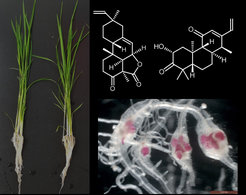
Phytoalexine sind antimikrobielle Sekundärmetaboliten mit niedrigem Molekulargewicht, die de novo synthetisiert werden und sich nach Krankheitserregerbefall rasch in Pflanzen anreichern. Phytoalexine sind in der Regel auf bestimmte Pflanzenfamilien verteilt, wie Camalexin bei den Kreuzblütengewächsen, Stilbenoide bei den Weinrebengewächsen und Leguminosen, Diterpenoide bei den Süßgräsern und Cumarine bei den Nachtschattengewächsen. Während die Forschung zu Camalexin und Stilbenen rasch voranschreitet, wissen wir über die Biochemie und die Funktionen anderer Phytoalexine viel weniger. Reis (Oryza sativa L.) ist eine wichtige Getreideart, die verschiedene diterpenoide Phytoalexine synthetisiert, darunter verschiedene Oryzalexine, Phytocassane und Momilactone. Die Zusammensetzung und der Gehalt an Phytoalexinen unterscheiden sich jedoch beträchtlich zwischen den Reissorten. Ein Screening einer großen Sammlung von Reissorten aus verschiedenen Teilen Asiens ergab, dass der Genotyp KPM eine Resistenz gegen den Wurzelknotennematoden Meloidogyne graminicola aufweist. Eine nicht zielgerichtete Metabolomanalyse deutete darauf hin, dass KPM mehrere diterpenoide Phytoalexine in sehr hohen Mengen im Vergleich zum anfälligen Genotyp Nipponbare synthetisiert (unveröffentlicht). Diese Ergebnisse sind sehr interessant, da diese Verbindungen bisher nicht gegen Wurzelpathogene untersucht wurden. Ziel dieses Projekts ist es, die Rolle dieser Stoffwechselprodukte bei der Bekämpfung von Wurzelknöterich-Nematoden zu klären. Wir sind auch daran interessiert zu untersuchen, wie die Induktion von diterpenoiden Phytoalexinen reguliert wird.
Dieses Projekt ist eine Kollaboration mit Prof. Godelieve Gheysen, Universität Gent, Belgien.