Biosynthese und Funktion der Bildung von Volatilen in verholzten Pflanzen und Gräsern
Viele Pflanzen reagieren auf den Fraß von Pflanzenfressern, indem sie komplexe flüchtige Gemische produzieren. Diese Gemische bestehen aus Verbindungen verschiedener chemischer Klassen wie Terpenoiden, aromatischen Estern und Blattgrünflüchtlingen. Wir untersuchen die biochemischen und genetischen Grundlagen der Herbivoren-induzierten Produktion flüchtiger Stoffe in Gehölzen und Gräsern. Die Gewinnung grundlegender Kenntnisse über diese Prozesse wird uns helfen, die biologische Rolle einzelner flüchtiger Verbindungen in Pflanzen-Insekten-Interaktionen aufzuklären.
Die Evolution der insekteninduzierten Terpenbiosynthese bei den Gräsern
Dr. Tobias Köllner
(in Zusammenarbeit mit Dr. Feng Chen, Universität von Tennessee)
Ziel dieses Projektes ist es, die molekularen Grundlagen der insekteninduzierten Terpenbiosynthese in Sorghum und die Evolution der verantwortlichen Terpensynthasen in verschiedenen Gräsern zu untersuchen. Derzeit haben wir drei Terpen-Synthase-Gene aus Sorghum identifiziert, die eine erhöhte Expression nach Herbivoren-Fütterung zeigten. Die biochemische Charakterisierung ergab, dass die drei TPS die gleichen Sesquiterpene produzieren, jedoch mit völlig unterschiedlichen Produktverteilungen. Vergleichende Studien mit Terpen-Synthase-Orthologen aus Sorghum, Reis und Mais werden uns helfen, Schlüsselaminosäuren zu identifizieren, die sich im Laufe der Evolution verändert haben und zu veränderten Produktspezifitäten führten.
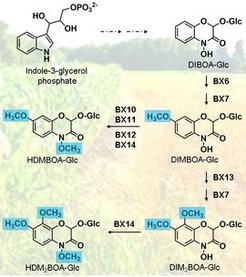
Benzoxazinoide (BXDs) sind pflanzliche Sekundärmetabolite, die für ihre defensiven und allelopathischen Eigenschaften bekannt sind. Sie werden hauptsächlich in Pflanzen aus der Familie der Gräser (Poaceae) produziert, darunter auch in landwirtschaftlichen Nutzpflanzen wie Mais, Weizen und Roggen. Die Biosynthese von BXDs wurde in Mais ausgiebig untersucht und insbesondere der Biosyntheseweg für die benzoxazinoiden Hydroxamsäuren ist in dieser Pflanze vollständig aufgeklärt. Der Kernweg beginnt mit Indol-3-Glycerinphosphat, das mehrere Oxidationen, eine Glucosylierung und eine Methylierung durchläuft, die zu 2,4-Dihydroxy-7-methoxy-1,4-benzoxazin-3-on-Glucosid (DIMBOA-Glc) führt. DIMBOA-Glc ist das am häufigsten vorkommende BXD in unbeschädigtem Mais, wird jedoch nach Herbivorenfraß in eine Vielzahl anderer Verbindungen wie HDMBOA-Glc, DIM2BOA-Glc und HDM2BOA-Glc umgewandelt. In Zusammenarbeit mit den Gruppen von Dr. Georg Jander (Boyce Thompson Institute, Ithaca, USA) und Prof. Dr. Matthias Erb (Universität Bern, Schweiz) haben wir kürzlich die Enzyme identifiziert und charakterisiert, die an der Bildung von HDMBOA-Glc, DIM2BOA-Glc und HDM2BOA-Glc in Mais beteiligt sind (siehe Abbildung). Das Ziel der vorliegenden Studie ist es, entsprechende Enzym-Homologe in Weizen zu identifizieren und zu untersuchen, wie sie sich möglicherweise entwickelt haben. Vorläufige BLAST-Analysen mit dem Weizengenom ergaben keine direkten Orthologe, was auf eine konvergente Evolution des DIMBOA-Glc-Stoffwechsels in den Gräsern hindeutet. Da Pilzbefall die Umwandlung von DIMBOA-Glc in andere BXDs in Weizen induzieren kann, wird uns ein transkriptomischer Datensatz, der von nicht befallenen und pilzbefallenen Weizenpflanzen stammt, helfen, hochregulierte Kandidatengene zu identifizieren. Weiterhin sind wir daran interessiert, die Biosynthese von benzoxazinoiden Lactamen wie HMBOA-Glc sowohl in Mais als auch in Weizen aufzuklären. Diese Verbindungen werden neben benzoxazinoiden Hydroxamidsäuren häufig in den Blättern gefunden, aber die für ihre Bildung verantwortlichen Enzyme sind noch unbekannt und die biologischen Rollen dieser Verbindungen sind unklar.
