Geliehene Gene: Schlüssel zu evolutionären Neuerungen bei der Interaktion zwischen Pflanzen und Insekten
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für chemische Ökologie
Biomasse und die Verteilung von Ressourcen
Pflanzen und Insekten befinden sich seit Millionen von Jahren in einem Zustand des immerwährenden koevolutionären Wettrüstens. Der Einsatz in diesem Wettkampf ist die durch Photosynthese entstandene pflanzliche Biomasse, die die Insekten versuchen zu konsumieren und in ihre eigene Biomasse umzuwandeln.
Die Waffen in diesem Wettkampf sind wiederum chemische Substanzen, einfache oder komplexe, die als tödliche Wirkstoffe oder als Kommunikations- und Täuschungssignale fungieren können. Ein Forschungsschwerpunkt am Max-Planck-Institut für chemische Ökologie hat zum Ziel, die Rolle dieser chemischen Signale, die Natur der dahinter liegenden ökologischen Interaktionen und ihre evolutionären Folgen für die beteiligten Pflanzen- und Tierarten zu verstehen.
Pflanzen verteidigen sich gegen Fraßinsekten, indem sie chemische Substanzen produzieren, die Insekten abschrecken oder vergiften. Würde eine Pflanze eine neuartige Abwehrstrategie entwickeln, die alle potenziellen Fraßfeinde töten könnte, die es auch nur wagten, sie anzuknabbern, könnte die Pflanze diesen selektiven Vorteil gegenüber ihren Konkurrenten nutzen: Er würde ausreichen, um eine neue Art entstehen zu lassen. Wenn aber ein pflanzenfressendes Insekt neue Methoden entwickelt, einen Abwehrstoff oder seine toxischen Folgen zu entgiften, kann dieses Insekt die pflanzliche Abwehr überwinden und die Pflanze als Nahrungsquelle allein nutzen. Der Vorteil wiederum, den dieses Insekt nun gegenüber seinen Konkurrenten besitzt, treibt dessen Differenzierung in eine neue Insektenart voran. Auf diese Weise führen immer neue Runden dieses ökologischen Spiels zu evolutiven Neuerungen. In der Tat geht man davon aus, dass dieser Prozess für die wachsende Zahl sowohl von Insekten- als auch Pflanzenarten über die vergangenen Jahrmillionen hinweg verantwortlich ist [1].
Beim Versuch, die Mechanismen eines solchen Entwicklungsablaufs sowohl auf der Pflanzen- als auch der Insektenseite zu entschlüsseln, stehen wir noch vor einem Rätsel. Jede neue Anpassung beziehungsweise Gegenanpassung muss durch eine genetische Veränderung im Genom der Pflanze oder des Insekts bedingt sein. Woher aber kommen diese neuen Gene? Gibt es irgendwelche Regelmäßigkeiten im Ursprung solch neuartiger Anpassungen? Handelt es sich um kleine Veränderungen in bereits bestehenden Abwehr- oder Angriffsmechanismen, die vorhersehbar wären, wenn wir diese Mechanismen auch im Detail verstehen würden? Oder handelt es sich um radikal neue Strategien, die auf umfassenden Veränderungen beruhen, einfach nur erfolgreich sind und sich damit durchgesetzt haben?
Die Forschung der Arbeitsgruppe um David Heckel sowie die Arbeit anderer Gruppen hat eine Reihe von unterschiedlichen Möglichkeiten zur Entstehung genetischer Neuheiten aufgedeckt. Im Folgenden werden vier dieser Möglichkeiten diskutiert: Von geringfügigen Funktionsänderungen oder Neuordnungen bereits im Genom vorhandener Gene bis hin zum „Ausleihen“ von Genen aus dem Genom anderer Arten.
Beispiel 1: Geringfügige Anpassungen, Umwandlung von Werkzeugen in Waffen
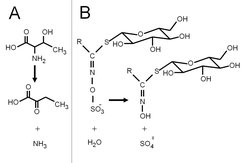
Bei einer Anpassung wird ein Enzym, das eine biochemische Reaktion katalysiert, nur leicht in seiner Funktion modifiziert oder in einem anderen Gewebe ausgeprägt. Diese geringfügige Veränderung reicht jedoch schon aus, weil sich auch der Kontext der Ausprägung (Expression) verändert. Das Enzym Threonin-Deaminase zum Beispiel bewerkstelligt in pflanzlichen und tierischen Zellen einen so genannten Salvage Pathway bestimmter Aminosäuren, indem es die Aminogruppe des Threonins abspaltet (Abb. 1A). Auf diese Weise wird das Kohlenstoff-Rückgrat des Moleküls gewissermaßen recycelt. Allerdings wurde kürzlich eine neuartige Form dieses Enzyms im Kot eines Insekts entdeckt, das sich von Tomatenpflanzen zu ernähren versuchte [2]. Diese Threonin-Deaminase wird zwar von Tomatenzellen und nicht vom Insekt produziert, war aber nur im Verdauungstrakt des fressenden Insekts aktiv. Im Gegensatz zu fast allen Tomatenproteinen, die vom Insekt schnell verdaut werden, ist dieses neuartige Enzym resistent gegen Proteasen und entfaltet besonders im Mitteldarm des Insekts seine Aktivität: Dort spaltet es die Aminogruppe der frei werdenden Threonin-Moleküle ab, die im Verlauf des Verdauungsprozesses entstehen. Die Folge: Das Insekt leidet, wenn es von Tomatenpflanzen frisst, an einem Mangel genau dieser Aminosäure. Die Änderungen in der Struktur des Enzyms, die es ihm ermöglichen, die rauen Bedingungen im Mitteldarm des Insekts zu „überleben“, verwandeln es von einem „Haushalts“-Enzym in eine offensive Waffe, die vor Pflanzen- (hier: Tomaten-) Fraß abschrecken kann, weil die Qualität der pflanzlichen Nahrung vermindert wird.
Ein weiteres Beispiel einer solchen Anpassung ist die Glucosinolat-Sulfatase (GSS), die von der Kohlmotte (Plutella xylostella), einem weltweit verbreiteten Pflanzenschädling, der insbesondere Kohl- und Senfarten befällt, produziert wird (Abb. 1B) [3]. Glucosinolate (auch: Senföl-Glycoside), eine große Klasse pflanzlicher chemischer Verbindungen, werden nach Spaltung durch Myrosinase-Enzyme in der Pflanze aktiviert und bilden stark wirksame Toxine (u.a. Isothiocyanate). Der Mechanismus wird ausgelöst, sobald die Blattzellen durch ein kauendes Insekt beschädigt werden und pflanzliche Myrosinasen mit Glucosinolaten unter Bildung der Isothiocyanate reagieren. Diese chemische Abwehrstrategie („Senföl-Bombe“) ist für kohlartige Pflanzen ausreichend, um die meisten Insektenarten fernzuhalten. Wird aber vor Reaktion der Myrosinasen die Sulfatgruppe an den Glucosinolat-Molekülen durch GSS entfernt, läuft deren Aktivierung nicht mehr ab und die für das Insekt giftigen Isothiocyanate werden nicht gebildet. Indem die Kohlmotte also ein eigenes, bereits existierendes Sulfatase-Enzym so modifiziert hat, dass es sowohl an pflanzlichen Glucosinolaten aktiv und dazu noch in das Lumen des Mitteldarms sekretiert werden kann, hat sie ein „Haushalts“-Enzym in ein Abwehrschild umgewandelt, das sehr effektiv und biochemisch gesehen simpel Pflanzengifte in harmlose Substanzen konvertiert.
Beispiel 2: Die Herstellung neuer Waffen durch Duplikationen
Ein vollständiges, proteinkodierendes Gen wird infolge eines Fehlers im genetischen Rekombinationsprozess nicht selten dupliziert. Das Tochtergen kann allmählich eine neue Funktion übernehmen, während das Muttergen wie bisher weiterarbeitet. Enzyme der Cytochrom-P450-Familie, die eine Reihe wichtiger Reaktionen mit molekularem Sauerstoff als Substrat katalysieren, sind ein hervorragendes Beispiel dafür. Sowohl Pflanzen als auch Insekten besitzen ein- bis zweihundert verschiedene P450-Enzyme. Es hat sich gezeigt, dass neuartige P450-Enzyme in Pflanzen eine Rolle in der Biosynthese chemischer Abwehrsubstanzen spielen – komplementär hierzu führt die Genverdopplung von P450-Enzymen in Insekten zur Entwicklung neuer Mechanismen für die Entgiftung dieser Substanzen.
Ein strukturell klar definierter Anteil eines Proteins wird als Domäne bezeichnet. Zusätzliche Domänen können einem bereits existierenden Protein durch interne Duplikation eines Teils des vollständigen Gens hinzugefügt werden. Wenn jedes Modul seine ursprüngliche Funktion beibehält, z.B. die Bindung eines Moleküls, verstärken die duplizierten, zusätzlichen Module genau diese Funktion des Proteins. Ein Beispiel hierfür sind die Protease-Hemmer, die von Pflanzen der Tabakfamilie gebildet werden: Sie binden und inaktivieren Proteasen (Protein-verstoffwechselnde Enzyme) in Insekten und stören so deren Nahrungsverwertung [4]. Viele dieser Protease-Hemmer haben vier, fünf oder sechs „hemmende“ Domänen in demselben Protein, sodass ein Molekül des Protease-Hemmers gleich mehrere Moleküle der Protease des Insekts außer Gefecht setzen kann.
Die kürzlich im Kohlweißling entdeckten NSP-Proteine (Nitrile Specifier Proteins) sind ein anderes interessantes Beispiel für eine Domänenduplikation, der wahrscheinlich eine Genduplikation vorausging und der Erwerb einer neuen Funktion nachfolgte [5]. Alle Insektenarten, die nachfolgend in Hinblick auf NSP-Homologe untersucht wurden, weisen ein kleines Protein von etwa 190 Aminosäuren auf, das im Mitteldarm vorkommt. Viele Arten haben komplexere Proteine, die aus bis zu zehn sich wiederholenden Einheiten der kleinen Proteine bestehen (Abb. 2). Die Funktionsweise dieser Proteine in anderen Insekten ist bislang unbekannt. Jedoch spielen sie wahrscheinlich eine wichtige Rolle, da Domänenduplikationen oft auf Proteine mit Schlüsselfunktionen hinweisen. Der Kohlweißling (Pieris rapae) hat zwei solcher Proteine, die jeweils drei Domän-Kopien beinhalten. Die Funktion des einen Proteins (hier MA genannt) ist unbekannt. Das NSP-Protein hingegen agiert im Mitteldarm der Kohlweißlingsraupe und schützt diese gegen die bereits oben erwähnten Glucosinolate, die vom Kohl als Abwehrsubstanz gegen Raupenfraß gebildet werden. Denn, anders als die Kohlmotte, hat der Kohlweißling keine Glucosinolat-Sulfatase, sodass die Senföl-Glycoside zunächst erfolgreich nach Myrosinase-Einwirkung aktiviert werden können und dann im Begriff sind, sich in toxische Isothiocyanate umzuwandeln. Genau in diesem zweiten Reaktionsschritt jedoch kontrolliert das NSP-Protein dessen Aktivierung dergestalt, dass an Stelle der Isothiocyanate die für das Insekt eher harmlosen Nitrilprodukte entstehen. Fazit: Der Kohlweißling macht Gebrauch von einer Variante der Domänenverdopplung, die in verschiedenen Insektenarten durchaus üblich ist, und konnte sie – zu seinem Vorteil – mit einer neuen Schutzfunktion ausstatten.

Beispiel 3: Das Stehlen gegnerischer Waffen für Täuschungsmanöver
In sehr seltenen Fällen wird DNA einer Art in das Chromosom einer anderen Art eingebunden. Auf diese Weise kann die zweite Art ein komplettes Gen der ersten Art erhalten. Die Häufigkeit dieses äußerst seltenen Ereignisses wird erhöht, wenn die zwei Arten in engem Kontakt miteinander stehen, wie z.B. bei Interaktionen zwischen Wirt und Parasit.
Viele Viren, die Insekten befallen, besitzen Gene, welche denjenigen Insektengenen stark ähneln, die für Wachstum und Entwicklung des Tieres verantwortlich sind [6]. Ein Virus kann das Wachstum seines Wirts zu seinem eigenen Vorteil beeinflussen, indem es seine eigene Version dieser Gene exprimiert. Es ist nicht unwahrscheinlich, dass ein im Infektionszyklus replizierendes Virus solche Gene aus dem Genom des Insekts „aufgreift“.
Umgekehrt kommt es vor, dass der Wirt Gene seines Parasiten erwirbt. Dazu folgendes Beipiel: Der Kohlweißling wird von einer Wespe angegriffen, die ihre Eier im Körper der Raupe ablegt. Die Wespe injiziert zusammen mit den Eiern ein Wespengift, welches auf das Immunsystem des Wirts einwirkt und dadurch die Parasiteneier schützt. So können die Wespenlarven unbehelligt aus den Eiern schlüpfen und die Kohlweißlingsraupe von innen auffressen. Bemerkenswert ist nun, dass ein Chromosom des Kohlweißlings ein Gen enthält, das dem Gen, welches das Wespen-Giftprotein kodiert, sehr ähnlich ist. Ein solches Gen findet man in keiner dem Kohlweißling verwandten Schmetterlingsart, und auch nicht in anderen, mit dem Parasiten verwandten Wespenarten. Das Giftprotein des Parasiten bildet, so wird angenommen, ein Dimer, das gegen den Wirt aktiv ist. Wird aber in ein Dimer die Proteinversion des Kohlweißlings eingebunden, ist das Gift inaktiv. Auf diese Weise nutzt also entweder die Raupe die von der Wespe gestohlene Proteinwaffe dazu, den Angriff des Parasiten zu sabotieren, oder der Parasit hat diese Waffe zur Manipulation des Kohlweißlings erlangt. Es ist noch unbekannt, ob es solche molekularen Interaktionen auch zwischen pflanzenfressenden Insekten und ihren Wirtspflanzen gibt.
Beispiel 4: Das Ausleihen von Waffen von am Kriegsgeschehen Unbeteiligten
Mittlerweile sind vollständige Genomsequenzen mehrerer Insektenarten verfügbar. Nach detaillierten, vergleichenden Untersuchungen findet man nicht selten ein Gen, das in einer Insektenart vorhanden ist, während es bei anderen Arten fehlt – dafür aber unerwarteterweise in bestimmten Bakteriengenomen vorhanden ist. Dies könnte auf einen möglichen Transfer bakterieller DNA in das Chromosom eines Insekts hindeuten. Aber: Wie können wir sicher sein, dass dieses Resultat kein Artefakt ist, welches allein auf die Verunreinigung von Insektengewebe mit Bakterien zurückzuführen ist, die im Verlauf der DNA-Präparationen „mitsequenziert“ wurden?
Ein kürzlich entdecktes Beispiel ist ein Gen aus Seidenspinnerraupen, welches das Enzym Saccharase (Invertase) kodiert, das Saccharose in seine zwei Komponenten Fruktose und Glukose spaltet. Die Wissenschaftler am MPI für chemische Ökologie konnten sehr ähnliche Gene in anderen Schmetterlings- und Mottenarten der Gattung Lepidoptera finden, jedoch keine Homologe in Insekten anderer Gattungen wie etwa Fliegen, Käfern, Ameisen oder Bienen. Da wenigstens ein Vertreter letzterer Gattungen vollständig sequenziert wurde, kann jetzt mit an Sicherheit grenzender Wahrscheinlichkeit davon ausgegangen werden, dass das Saccharase-Gen in diesen Gattungen tatsächlich nicht vorhanden ist. Mehrere Bakterienarten, von denen bekannt ist, dass sie im Laufe ihres Lebenszyklus mit Insekten assoziiert sind, wiederum besitzen Saccharase-Gene, die denen des Seidenspinners sehr ähnlich sind (Abb. 3).
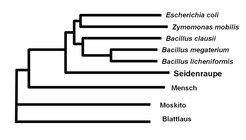
In der Genomsequenz des Seidenspinners taucht das bakterienähnliche Saccharase-Gen an einer Stelle auf, wo es von anderen insektenspezifischen Genen umgeben ist, die keinerlei Ähnlichkeit mit bakteriellen Genen haben – ein wichtiger Nachweis, dass es auf einem Chromosom des Seidenspinners (Eukaryont) lokalisiert ist und eben nicht etwa auf eine Verunreinigung mit einem z.B. symbiontischen Bakterium (Prokaryont) zurückgeführt werden kann. Jedoch eine Frage bleibt: Der Seidenspinner hat viele verschiedene Saccharase-Gene, die denen anderer Insekten und Tiere viel ähnlicher sind als denen von Bakterien. Warum braucht er also noch eine zusätzliche Saccharase, deren Spur in Richtung Prokaryonten weist?
Die bakterienähnliche Saccharase wird derzeit von Heckel und seinem Team untersucht, um das Rätsel seines mysteriösen Auftauchens in Schmetterlingen und Motten zu lösen. Die Hypothese der Forscher ist, dass Pflanzen Substanzen bilden, die spezifisch Saccharasen von Insekten hemmen, ähnlich wie es die oben beschriebenen pflanzlichen Protease-Hemmer tun: Auch die Blockierung der Saccharase-Aktivität könnte Herbivorie stark beschränken, weil der Nährwert der Pflanze für das Insekt wegen mangelnder Verstoffwechselung der Saccharose gemindert wird. Weil sich aber die Struktur bakterieller Saccharasen nicht unerheblich von der aus Insekten unterscheidet, ist sie möglicherweise quasi von Natur aus resistent gegenüber den pflanzlichen Saccharase-Hemmern und ermöglicht so dem Insekt, die Blattnahrung optimal zu verstoffwechseln. Damit besäße das Insekt gegenüber seinem Pflanzenwirt den Vorteil, ein voll funktionierendes Saccharase-Verdauungsenzym zu besitzen – zumindest im Moment, da die Wirtspflanzen im Verlauf der Evolution vielleicht noch nicht einen entsprechenden Hemmstoff gegen Saccharasen bakteriellen Ursprungs entwickelt haben.
Diese Beispiele zeigen alle, dass in der koevolutionären Auseinandersetzung zwischen Pflanzen und Insekten beide Seiten neue Mechanismen entwickeln können, die entweder aus einem vorhandenen Arsenal oder aus dem Werkzeugkasten anderer, am Geschehen Beteiligter oder Unbeteiligter, stammen. Dies alles passt sehr gut zu der Ansicht, dass die Evolution ein opportunistischer Prozess ist, der durch stete, konsequente Neuentwicklungen und manchmal auch mit Überraschungen voranschreitet.


