Lebende Chemiefabriken: Chemische Verteidigung bei Blattkäferlarven
Forschungsbericht (importiert) 2008 - Max-Planck-Institut für chemische Ökologie
Die chemische Abwehr mancher Käferarten wird durch ihre Wirtspflanze bestimmt
Die Käfer (Coleoptera) sind mit über 350.000 Arten in etwa 20 Überfamilien und 166 Familien die weltweit größte Ordnung aus der Klasse der Insekten. Seit mehr als 240 Millionen Jahren nutzen Käfer Bedecktsamer als Nahrungsquelle, was zu einer wechselseitigen Anpassung führte und erheblich zu der heute zu beobachtenden Artenvielfalt beider Organismengruppen beitrug [1]. Bei den im Verlaufe der Evolution stattfindenden Adaptationsprozessen spielen Naturstoffe (Sekundärmetabolite) eine entscheidende Rolle. Pflanzenfressende (phytophage) Käfer entwickelten verschiedene Taktiken im Umgang mit pflanzlichen Sekundärmetaboliten, wobei der Sequestrierung, das heißt der Aufnahme und Speicherung von Pflanzeninhaltsstoffen aus der Nahrung, eine wichtige Rolle zukommt. Vor allem innerhalb der Familie der Blattkäfer (Chrysomelidae) ist die Nutzung sequestrierter Verbindungen für die eigene Abwehr von Fraßfeinden weit verbreitet [1]. Häufig führt der Erwerb der Sequestrierung zu einer Spezialisierung der jeweiligen Chrysomeliden-Art auf einen bestimmten Wirt und stellt einen wichtigen Faktor dar, der zur Koevolution von Pflanze und Konsument beiträgt.
Innerhalb der Chrysomelidae sind viele Spezies bekannt, bei denen sich nicht nur die adulten Käfer, sondern auch die Larven durch Pflanzeninhaltsstoffe schützen [2]. So besitzen die Larven des Subtribus Chrysomelina auf dem Rücken spezielle Drüsen, in denen solche Verbindungen gespeichert und bei Gefahr als Sekret abgesondert werden (Abb. 1).

Chrysomelina-Larven können die wirksamen Komponenten ihres Wehrsekretes entweder autogen synthetisieren oder Vorstufen aus der Nahrung sequestrieren. Dabei scheint die de-novo-Synthese von cyclopentanoiden Monoterpenen (Iridoiden) eine entwicklungsgeschichtlich alte Fähigkeit zu sein [3], (Abb. 2a). Sequestriert werden von diesen Tieren biologisch inaktive Glucoside, die erst im Drüsenreservoir in die aktive Form umgewandelt werden. Dadurch gestaltet sich die Synthese von Abwehrsubstanzen einerseits ökonomischer, andererseits liefert die freigewordene Glucose aus dem Glucosidkatabolismus zusätzliche Energie. Im Gegensatz zur Nutzung von nur einem einzigen Sekundärmetaboliten aus der Wirtspflanze – wie zum Beispiel Salicin, das zu Salicylaldehyd umgesetzt wird – gibt es innerhalb der Chrysomelina-Gruppe Arten, die Glucoside verschiedenster Alkohole aufnehmen und mit autogen synthetisierten Carbonsäuren verestern, was zu mehr als 70 verschiedenen Verbindungen im Wehrsekret führt (Abb. 2b,c). Kombiniert man dieses entwicklungsgeschichtliche Szenario mit der Abhängigkeit von der Wirtspflanze, so können Stammbäume erstellt werden, die die wechselseitige Anpassung von Blattkäfern und Wirt widerspiegeln [3,4], (Abb. 2d).
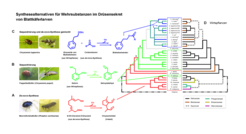
So sind Arten, die ausschließlich Salicin sequestrieren, an Weidengewächse adaptiert. Interessanterweise wurden im zentralasiatischen Altai von einer Chrysomelina-Art (C. lapponica) Populationen auf Weide und Birke entdeckt, sodass hier bereits ein Wirtswechsel innerhalb einer Spezies stattgefunden hat. Dadurch verändern sich die Komponenten des Abwehrsekretes, was sich auch auf das Spektrum der Fraßfeinde im neuen Lebensraum auswirken kann. Im Verlauf der Evolution müssen Sequestrierer sich also immer wieder mit der Wirkung neuer pflanzlicher Sekundärmetabolite auseinandersetzen.
Transportproteine vermitteln die Aufnahme von Pflanzeninhaltsstoffen
Um Faktoren zu identifizieren, die sich bei einem Wirtswechsel verändern, wurden die Vorgänge, die in den Blattkäferlarven bei der Sequestrierung ablaufen, genauer untersucht. Zunächst konnte anhand von Fütterungsexperimenten mit eigens dafür synthetisierten Thioglucosiden gezeigt werden, dass Transportproteine den Import pflanzlicher Glucoside in die Larven vermitteln müssen [5,6]. Diese strukturellen S-Analoga der natürlichen O-Glucoside eignen sich wegen ihrer Stabilität gegenüber enzymatischer Hydrolyse sehr gut für die Untersuchung von Transportvorgängen. Mit der Nahrung aufgenommene Thioglucoside akkumulierten als intaktes Molekül im Reservoir der Wehrdrüse, sodass sie sowohl die Darmmembran als auch die Membran der Wehrdrüse passiert haben mussten. Dies wäre bei den polaren Glucosiden ohne Transportproteine nicht möglich und erlaubt eine kontrollierte Passage zum Zielort.
Die Wissenschaftler am Max-Planck-Institut für chemische Ökologie konnten ferner nachweisen, dass selbst de-novo-Produzenten potenziell zur Sequestrierung imstande sind [5]. Fütterungen strukturell unterschiedlicher S-Glucoside zeigten, dass die Iridoidproduzenten nur das S-Glucosid ihrer terpenoiden Vorstufe aufnehmen, während die Sequestrierer ausschließlich das S-Analogon des Salicins importieren [6]. Von einer Art, innerhalb derer bereits ein Wirtspflanzenwechsel stattfand, wurden Larven von Weiden- und Birken-Populationen untersucht. Es zeigte sich, dass alle untersuchten Vertreter prinzipiell in der Lage sind, sowohl Salicin als auch in geringem Ausmaß andere glucosidisch gebundene Alkohole zu sequestrieren [7]. Eine Erweiterung des Substratspektrums der Transportproteine, die für die Naturstoffaufnahme verantwortlich sind, könnte demzufolge für den Wirtspflanzenwechsel eine wichtige Voraussetzung gewesen sein.
Auch de-novo-Produzenten können Pflanzeninhaltsstoffe aufnehmen
Die Entdeckung, dass auch Vertreter der de-novo-Produzenten Transportsysteme zur Aufnahme von Pflanzeninhaltsstoffen besitzen, wirft die Frage auf, inwieweit die Sequestrierung unter natürlichen Bedingungen dort schon eine Rolle spielt. Um eine tatsächliche Aufnahme aus der Pflanze nachzuweisen, wurde ein markiertes Intermediat eines für Pflanzen und Bakterien einzigartigen Stoffwechselweges (MEP-Route) eingesetzt, der Vorstufen für die Terpenoidsynthese liefert [8]. Zunächst wurde Blattmaterial mit dieser eigens für Fraßexperimente synthetisierten markierten Vorstufe behandelt und dann an die Blattkäferlarven verfüttert. Eine Analyse ihres Sekretes ergab den Einbau pflanzenbürtiger Terpenoide in die iridoidalen Wehrsubstanzen bei Arten, die sich an Weidengewächse angepasst hatten. Durch den Einsatz analytischer Methoden konnte eine potenzielle Iridoidvorstufe in den entsprechenden Wirtspflanzen, wie in Weide und Pappel, identifiziert werden, sodass tatsächlich auch bei de-novo-produzierenden Arten Sequestrierung nachweisbar ist.
Zusätzlich konnte gezeigt werden, dass nicht nur das Glucosid, sondern auch das Aglucon der Iridoidvorstufe, nämlich 8-OH-Geraniol, die Darmmembran passieren kann [8], (Abb. 3). Letzteres wurde jedoch auf seiner Passage zur Wehrdrüse mit einem Glucoserest versehen. Das Aglucon selbst war im Sekret nicht nachweisbar. Da sich die Glucoside nur kontrolliert mithilfe von Transportern durch Membranen hindurch bewegen können, schützt die Larve sich so vor ungehinderter Diffusion potenziell giftiger Substanzen.

Die Forscher nehmen an, dass die Glucosylierung im Fettkörper, einem biosynthetisch hoch aktiven Gewebe der Larven, stattfindet. Durch die Verknüpfung von molekularbiologischen und analytischen Methoden konnten sie zeigen, dass die frühen Stufen der Iridoidbiosynthese scheinbar im Fettkörper ablaufen, wobei als letzte frühe Stufe der Terpenbiosynthese das Glucosid des 8-OH-Geraniols gebildet wird, das dort mit der Hämolymphe zur Wehrdrüse transportiert wird, wo die „Toxifizierung“ stattfindet [9], siehe Abbildung 4. Vergleiche mit anderen Geweben, auch mit Fettkörpergewebe von Salicin-sequestrierenden Larven, deuteten sowohl durch eine erhöhte Transkription als auch enzymatische Aktivität der Hydroxymethylglutaryl-CoA-Reduktase (HMGR) auf eine Lokalisierung dieser Syntheseschritte im Fettkörper hin. HMGR ist ein Schlüsselenzym des Mevalonatwegs und damit auch der frühen Iridoidsynthese, welches die Vorstufen zur Bildung aller Terpenoide im tierischen Organismus liefert. Durch den tatsächlichen Nachweis des 8-OH-Geraniol-O-Glucosids im Fettkörper der Iridoidproduzenten konnten diese Ergebnisse auch analytisch gestützt werden.

Die Fähigkeit, Vorstufen de novo und über Sequestrierung gewinnen zu können, wirft die Frage auf, ob die Larven auch in der Lage sind, beide Prozesse zu koordinieren. So könnten gemeinsame Vorstufen beider Prozesse (z. B. 8-OH-Geraniol oder das Glucosid) in die Regulation der de-novo-Synthese eingreifen. Hemmexperimente der HMGR mit Rohenzymextrakt aus dem Fettkörper oder gereinigtem rekombinanten Protein zeigten, dass 8-OH-Geraniol, aber weder sein Glucosid noch Geraniol, die Aktivität der HMGR inhibiert [10], (Abb. 4). Damit könnten nicht nur endogene, sondern auch exogene Intermediate des Terpenoidstoffwechsels in die Regulation seiner Enzyme eingreifen und je nach Angebot in der Wirtspflanze oder Verbrauch des Wehrsekretes de-novo-Synthese und Sequestrierung ausbalancieren. Solch ein duales System zur Herstellung von Wehrsubstanzen könnte dazu beitragen, dass Wirtspflanzen leichter gewechselt werden können, ohne den Schutz vor Fraßfeinden zu verlieren.
Die Studien an Chrysomelina-Käfern zeigen die Komplexität des Sequestrierungsprozesses, dessen Entwicklung Folgen für die Wechselwirkung der Arten in einem Lebensraum haben kann. Da die Sequestrierung von Glucosiden ein weit verbreitetes Phänomen im Tierreich ist, könnten die anhand des Chrysomelina-Modells gewonnenen Erkenntnisse auf andere Arten übertragbar sein.

![Rekonstruktion der Phylogenie des Subtribus Chrysomelina unter Berücksichtigung der Biosynthesestrategien der Wehrverbindungen. A: rot, autogene Biosynthese von Iridoiden; B: grün, Produktion von Salicylaldehyd ausgehend von Salicin (Sequestrierung aus Pflanzen der Salicaceae-Familie); C: blau, Produktion von Esterverbindungen, die aus de-novo-synthetisierter Carbonsäure und sequestrierten, glucosidisch gebundenen Alkoholen gebildet werden; D: Rekonstruktion der Phylogenie anhand mitochondrialer Kontrollregionen und unter Berücksichtigung der Wirtspflanzenabhängigkeit (nach Termonia et al. [3]). Rekonstruktion der Phylogenie des Subtribus Chrysomelina unter Berücksichtigung der Biosynthesestrategien der Wehrverbindungen. A: rot, autogene Biosy](https://www.mpg.de/419667/original-1293749231.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDE5NjY3fQ%3D%3D--a5f560e4bbc4bb010328f127bb747020ff303272)

