Die Welt der Naturstoffe: Untersuchungen von Esterverbindungen und Acyltransferasen am Modellsystem Arabidopsis thaliana
Forschungsbericht (importiert) 2008 - Max-Planck-Institut für chemische Ökologie
Einführung
Pflanzen haben viele Strategien entwickelt, um mit ihrer biotischen und abiotischen Umwelt zu interagieren. Diese Interaktionen werden durch chemische Substanzen vermittelt, die unter der Bezeichnung sekundäre oder spezielle Stoffwechselprodukte bekannt sind. Diese chemischen Verbindungen haben unterschiedlichste Funktionen, vom Anlocken der Bestäuber bis hin zur Abwehr von Fraßfeinden. Seit Menschengedenken wurden pflanzliche Sekundärmetabolite sowohl als Geschmacks- und Aromastoffe als auch für medizinische Zwecke verwendet. Immer mehr erweist sich eine wachsende Zahl von pflanzlichen Naturstoffen auch als hilfreich in der Behandlung von schweren Krankheiten wie zum Beispiel Krebs.
Trotz der großen Anzahl sekundärer Stoffwechselprodukte aus dem Pflanzenreich –mindestens 50.000 – gibt es nur wenige Stoffwechselwege, die zur Synthese der Grundgerüste dieser Verbindungen führen. Viele Pflanzenbiochemiker beschäftigen sich nun mit der sowohl wichtigen wie auch faszinierenden Fragestellung: Wie kann solch eine enorme Vielfalt an Verbindungen entstehen, obwohl die grundlegenden Stoffwechselwege so begrenzt sind? In der Tat, den größten Beitrag zur Vervielfältigung und „Verzierung“ molekularer Grundgerüste aus dem Sekundärstoffwechsel leisten unzählige verschiedene Arten von Enzymen, die den Pflanzen zur Verfügung stehen. Diese Enzyme katalysieren biochemische Grundreaktionen wie Decarboxylierungen, Oxidationen/Reduktionen, Hydroxylierungen, Ringschlüsse (Zyklisierungen), Methylierungen und Acylierungen [1].
Die Modifizierung von sauerstoff- und stickstoffhaltigen Substraten mittels Acylierung, um Ester oder Amine zu produzieren, ist eine der häufigsten Modifikationen im pflanzlichen Sekundärmetabolismus. Die neuesten Erkenntnisse aus der Pflanzengenom-Sequenzierung und die immer größer werdende Anzahl an Enzymen, die in verschiedenen Pflanzenarten charakterisiert wurden, haben gezeigt: Die Enzyme, die Acylierungsreaktionen katalysieren, sind nicht nur zahlreich, sondern gehören oft auch umfangreichen Proteinfamilien an. Die aktivierten Acyl-Donoren, die in diesen Reaktionen benötigt werden, kommen aus verschiedenen Quellen wie zum Beispiel Acylzuckern, Acyl-Carrier-Proteinen oder Acyl-Coenzym A-Thioestern. Genauso wie die Enzyme, die diese Substrate umsetzen, so gehören auch diejenigen Enzyme, die die Acyl-Donoren herstellen, zu unterschiedlichen Proteinfamilien.
Die laufenden Sequenzierungs-Projekte haben, zusammen mit der vorliegenden biochemischen Evidenz, zur Entdeckung einer Familie von Acyltransferasen mit dem Namen BAHD geführt. (Der Name ist von den ersten vier Enzymen, die entdeckt worden waren, abgeleitet.) Diese BAHD-Acyltransferasen nutzen CoA-Thioester und katalysieren die Bildung spezieller pflanzlicher Metabolite. Mindestens 50 verschiedenen Acyltransferasen konnte, basierend auf genetischen und/oder biochemischen Experimenten, eine Funktion zugewiesen werden [2]. Viele weitere Acyltransferase-kodierende Sequenzen aus einer Vielzahl von Pflanzenarten existieren in öffentlichen Gen- und Genexpressions-Datenbanken. Die Herausforderungen, die es nun zu bewältigen gilt, sind die Charakterisierung dieser Enzyme, ihre Integration in ein umfassendes Verständnis der Vorgänge, die zum Anstieg ihrer Diversifizierung führten, und die Beantwortung der Frage, welche Rolle die von ihnen synthetisierten Pflanzensekundärstoffe spielen.
Arabidopsis thaliana: Ein Modellsystem zum Verständnis des Acyltransfers in Pflanzen
Die Art Arabidopsis thaliana – vielen bekannt als Acker-Schmalwand – ist ein beliebtes Modellsystem für Untersuchungen verschiedener Aspekte der Pflanzenbiologie, von der Atmung bis zur Fortpflanzung. Bis vor kurzem schien es jedoch zweifelhaft, ob diese Pflanzenart (oder überhaupt andere Arten) als geeignetes Modell für Untersuchungen des pflanzlichen Sekundärmetabolismus dienen kann. Allerdings hat die vollständige Genomsequenzierung dieser kleinen, mit Senf und Raps verwandten Pflanze gezeigt, dass Enzymfamilien vorhanden sind, die spezielle Metabolite weiter umwandeln können [3]. Die Mehrzahl dieser potenziellen Gene und Enzyme ist noch nicht charakterisiert, wobei sich hingegen mit der Verbesserung der chemischen Analysemethoden die Anzahl der in ihrer Struktur aufgeklärten Sekundärmetabolite in den letzten Jahren mehr als verdreifacht hat.
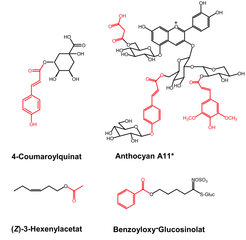
Die Forschung der Wissenschaftler aus der Abteilung Biochemie am Max-Planck-Institut für chemische Ökologie (Jonathan Gershenzon) fokussiert auf die biochemische Beschreibung von Acyltransferasen in Arabidopsis. Diese Enzyme sind möglicherweise verantwortlich für die Bildung vieler veresterter Naturstoffe, die kleine flüchtige Verbindungen, größere Pigmenten und Abwehrstoffe gegen Pilzbefall (sogenannte Phytoalexine) umfassen. Abbildung 1 zeigt Beispiele bekannter veresterter Metabolite, die in Arabidopsis identifiziert wurden. In den folgenden Abschnitten werden wir einige der Methoden und Ergebnisse vorstellen, die bei der Identifizierung derjenigen Gene und Enzyme geholfen haben, welche verantwortlich für die Bildung dieser Verbindungen sind.
Wie die Bildung von grünen Blattduftstoffen gesteuert wird
Grüne Blattduftstoffe – Green Leaf Volatile (GLVs) – bezeichnen eine Klasse von Verbindungen, die überall im Pflanzenreich gefunden werden. Die am häufigsten dokumentierten GLVs werden von Linolen- und Linolsäure abgeleitet [4]. Ihre Biosynthese umfasst im ersten Schritt die Bildung eines Hydroperoxids, katalysiert durch das Enzym Lipoxygenase, gefolgt von einer Spaltung an C12, die durch eine Hydroperoxid-Lyase vermittelt wird. Die Produkte dieser Spaltung sind eine nichtflüchtige C12-Säure sowie ein flüchtiger C6-Aldehyd (Abb. 2). Die Abgabe von grünen Blattduftstoffen erfolgt in der Regel durch vegetatives Pflanzengewebe, das von Herbivoren angefressen oder auf eine andere Art verletzt wurde (Rasenmäher!). Allerdings wurden diese Verbindungen auch als flüchtige Bestandteile von Blüten und Früchten vieler verschiedener Pflanzenarten identifiziert. Die ökologische Bedeutung der grünen Pflanzenduftstoffe ist vielfältig. So wird inzwischen weitläufig angenommen, dass diese Verbindungen als luftübertragbare Signale dienen, welche die Feinde der Herbivoren anlocken sollen – und so die Pflanze vor Fraß schützen können [5]. Darüber hinaus zeigen GLVs eine antibakterielle und antifungale Wirkung.
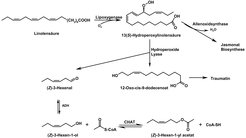
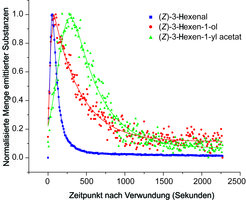
Durch eine spezielle Methode, biochemical genomics, wurde das Enzym identifiziert, das verantwortlich für die Entstehung des (Z)-3-Hexen-1-yl-Acetats ist [6]. Es wurde (Z)-3-Hexen-1-ol-Acetyltransferase (CHAT) genannt und ist mit anderen flüchtige Ester bildenden Acyltransferasen aus der BAHD-Familie verwandt. Eine vollständige biochemische Charakterisierung des Proteins zeigte, dass CHAT – wie viele andere BAHD-Acyltransferasen – verschiedene kurzkettige Alkohole als Substrate verwenden konnte [7]. Die Menge an CHAT-Enzym stieg infolge mechanischer Verwundung an (Anschneiden der Blätter mit einer Rasierklinge), und es kam zu einer verstärkten Produktion des Esters, wenn die Pflanzen ein zweites Mal verwundet wurden. Darüber hinaus wurde das CHAT-kodierende Gen mit den Genen, die die Enzyme des Lipoxygenase-Signalwegs kodieren, koreguliert (vgl. Abb. 2). Somit ist die Pflanze, wenn sie verwundet wird, in der Lage, ausreichend (Z)-3-Hexen-1-yl-Acetat zu produzieren, indem sie nicht nur die Menge des CHAT-Enzyms, sondern auch der im Biosyntheseweg stromaufwärts liegenden Enzyme vergrößert. Um die Bildung und Emission von GLVs nach mechanischer Verwundung vollständig zu verstehen, wurde zusätzlich eine neue Echtzeit-Methode zur Analyse von flüchtigen Verbindungen verwendet, die so genannte Proton-Transfer-Reaktions-Massenspektrometrie (PTRMS). Die Messungen zeigten und bestätigten, dass dem CHAT-Enzym nach mechanischer Verwundung ausreichend (Z)-3-Hexen-1-ol zur Verfügung gestellt wird und es innerhalb von 500 Sekunden nach der ersten Verwundung die größte Menge an (Z)-3-Hexen-1-yl-Acetat produziert (Abb. 3). Die Bildung des Aldehyds (Z-3-Hexenal) und des Alkohol-Substrats (Z-3-Hexen-1-ol) gehen der Ester-Bildung voraus, wie es entsprechend der Abfolge des Stoffwechselweges zu erwarten war.
Arabidopsis-Anthocyane werden durch Veresterung modifiziert
Pflanzen bilden auch ein breites Spektrum von chemischen Verbindungen, die als Pigmente dienen. Diese Pigmente sorgen für Färbungen, die von hellrosa bis dunkelblau und lila reichen, und sind für Pflanzen in vielerlei Hinsicht von Nutzen. Besonders wichtig ist ihre Schutzfunktion, denn sie sorgen dafür, dass wichtige Gewebe vor schädlichen UV-Strahlen geschützt werden. Allerdings haben Pigmente auch eine Signalfunktion für Bestäuber, die durch die Blütenfarben angelockt werden – unerlässlich für die Pflanzen im Hinblick auf eine erfolgreiche Befruchtung und Fortpflanzung. Eine der wichtigsten Klassen von pflanzlichen Pigmentverbindungen sind die Anthocyane.
Anthocyane sind eine große Klasse von glycosylierten Flavonoiden, die verantwortlich für nahezu alle Lila-, Blau- und Rosafärbungen angiospermer Blätter und Blüten sind, zusätzlich bewirken sie auch viele Rot- und Orangefärbungen. In der Literatur wird von mehr als 500 verschiedenen, in der Natur vorkommenden Anthocyanen berichtet [8]. Die Mehrzahl der Diversifikationen in den Anthocyan-Strukturen ist zurückzuführen auf die Kopplung von zusätzlichen Zuckermolekülen an die Grundstruktur, die aus drei Ringen besteht, sowie auf die Acylierung der Zucker durch kurzkettige aliphatische Säuren oder Hydroxycinnaminsäuren, die aus der Aminosäure Phenylalanin hervorgehen.
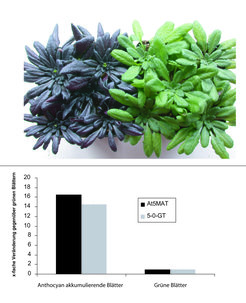
In unseren anfänglichen Versuchen, die BAHD-Mitglieder in A. thaliana zu charakterisieren, führten wir eine chemische Analyse von Blättern durch, die dem Stressfaktor Trockenheit ausgesetzt waren. Wir konnten bestimmen und bestätigen, dass das Haupt-Anthocyan-Pigment, das gebildet wurde und durch das sich die Blätter dunkelrot verfärbten, ein Cyan-Derivat ist, das durch Acylgruppen an drei Stellen modifiziert wurde (Anthocyan A11, siehe Abb. 1).
Im Anschluss an diese Beobachtung wurden diejenigen BAHD-Gene genauer untersucht, die aktiviert worden waren, als sich die Blätter von grün zu dunkelrot verfärbten. Identifiziert wurde ein BAHD-Gen, dessen Transkriptmenge sich während dieser Verfärbung um mehr als das 20fache vergrößerte. Interessanterweise war ein weiteres Gen, das ein Enzym kodiert, welches ein Zuckermolekül an die Grundstruktur bindet (5-O-GT), mit der Transkript-aktivierten BAHD-Acyltransferase eng koreguliert (Abb. 4). Die biochemische Charakterisierung des BAHD-Enzyms zeigte, dass es sich um eine Anthocyan-5-O-glucosid-6’’-O-Malonyltransferase (At5MAT) handelt [9].
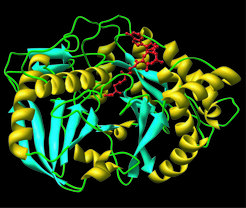
Die katalytischen Eigenschaften eines Enzyms sind vom aktiven Zentrum im Protein abhängig, das von den dort vorhandenen Aminosäureresten bestimmt wird. Untersuchungen des At5MAT-Proteins zeigten, dass nicht nur seine Nutzung des Malonyl-CoA als Substrat sehr spezifisch ist, sondern auch, dass diese Malonyl-Gruppe nur an das 5’-Zuckermolekül bindet, das im Anthocyanmolekül vorhanden ist. Um zu verstehen, was diese hohe Selektivität bewirkt, wurde das At5MAT-Protein in großen Mengen hergestellt, gereinigt und Bedingungen unterworfen, unter denen es eine kristalline Matrix bilden kann. In Zusammenarbeit mit Mitarbeitern aus dem Labor von Joseph P. Noel am Salk Institute in San Diego, Kalifornien, wurden die At5MAT-Kristalle Röntgenstrahlen ausgesetzt, um die dreidimensionale Struktur des Proteins aufzuklären. Inzwischen liegt ein dreidimensionales Modell der Acyltransferase vor mit am aktiven Zentrum gebundenem Malonyl CoA (Abb. 5). Dieses Modell ermöglicht die Vorhersage, welche Aminosäurereste für die Katalyse und die Besonderheit der Acyl-Modifizierung bedeutsam sind. Die nun folgende Erzeugung von Mutanten, die substituierte Aminosäuren enthalten, wird helfen zu verstehen, wie die At5MAT-Acyltransferase ihre besondere katalytische Selektivität erlangt. Das detaillierte Verstehen des Katalyseprozesses dieses Enzyms soll weiterhin ermöglichen, mithilfe daraus abgeleiteter Modelle potenzielle Substrate ähnlicher BAHD-Acyltransferase-Mitglieder vorherzusagen.
Ausblick
Unser Verständnis darüber, wie Ester-Bildung zur Diversifizierung des sekundären Pflanzenstoffwechsels beiträgt, hat sich in den vergangenen Jahren bedeutend vergrößert. Mit neuen Techniken aus der Modellsystembiologie und -biochemie ist es inzwischen möglich geworden, die Funktionen einzelner Mitglieder der BAHD-Acyltransferase-Familie aufzuklären. Sobald die Besonderheiten ihrer Katalysefunktionen verstanden sind und erkannt wurde, welche Aminosäuren für die Synthese der speziellen sekundären Pflanzenmetabolite verantwortlich sind, kann begonnen werden zu untersuchen, wie diese Enzyme evolviert sind, um immer wieder neue Substrate zu binden, und wie dieser Prozess letztendlich die Diversität der sekundären Pflanzenmetabolite immer mehr vergrößert hat.
Weiterhin haben die Wissenschaftler Methoden auf der Basis transgener Pflanzen entwickelt, die ausgewählte acylierte Verbindungen nicht mehr produzieren können. Mit deren Hilfe können die biologischen Funktionen, die die Substanzen während der Interaktion der Pflanze mit ihrer Umwelt übernehmen, studiert und manifestiert werden.
![Beispiele veresterter Sekundärmetabolite, die in Arabidopsis thaliana gefunden wurden. Die Strukturen, die rot hervorgehoben sind, zeigen die Acyl-Reste, die ihren jeweiligen Coenzym A-Thioestern entsprechen. * Cyanidin 3-O-[2-O(2-O(sinapoyl)-beta-D-xylopyranosyl)-6-O-(4-O-(beta-D-glucopyranosyl)-p-coumaroyl-beta-D-glucopyranosid] 5-O-[6-O-(malonyl) beta-D-glucopyranosid] Beispiele veresterter Sekundärmetabolite, die in Arabidopsis thaliana gefunden wurden. Die Strukturen, die rot hervorgehoben sind, zeigen die Acyl-Re](https://www.mpg.de/402150/original-1293750361.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDAyMTUwfQ%3D%3D--0821e368d4865380ca4010580caf781111e56525)



