Mikroanalyse von spezialisierten Naturstoffen
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für chemische Ökologie
Einführung
Die Mauer einer mittelalterlichen Stadt gewährte den Bewohnern Schutz vor Eindringlingen und sicherte ihnen ein bisweilen ungestörtes Leben. Tore erlaubten das Verlassen und den Zutritt zur Stadt für Versorgung und allerlei Geschäft und um Gäste zu begrüßen. Stadttore aber waren zugleich auch Einfallsorte für Besucher mit unlauteren Absichten und wurden deshalb besonders beobachtet und geschützt. Andererseits sandte ein Fähnchen auf dem höchsten Turm dem Reisenden schon aus der Ferne einen Gruß. Friedliche Besucher waren willkommen und beförderten oft den Wohlstand des Ortes.
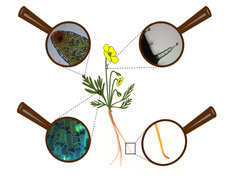
Ähnlich verhält es sich mit einem Organismus: Lebensvorgänge finden im Inneren statt. Die Aufnahme von Stoffen und die Registrierung von Signalen geschehen weitgehend über speziell dafür angelegte Organe. Im Pflanzenreich regeln z.B. mikroskopisch kleine Spaltöffnungen an der Unterseite der Blätter den für die Photosynthese notwendigen Gasaustausch (Abb. 1, unten links). Pilzhyphen können jedoch die Spaltöffnungen nutzen, um in das Pflanzengewebe einzudringen und die Pflanze zu infizieren. Wurzeln nehmen Wasser und Nährstoffe aus dem Boden auf und sind dabei vielfältigen Gefährdungen durch verschiedenste Bodenbewohner ausgesetzt. Die zarte Wurzelspitze muss sich beim Wachstum durch den Boden den Weg bahnen und hat u. a. die Aufgabe, den Boden durch Abgabe von Stoffen für ihre weitere Ausbreitung vorzubereiten (Abb. 1, unten rechts). In beiden Beispielen – in den Zellen der Spaltöffnungen und in der Wurzelspitze – findet man oft eine Anreicherung von Naturstoffen mit fungitoxischen oder antibakteriellen Wirkungen. Andere Organe, wie z. B. Trichome (Pflanzenhaare) auf der Oberfläche (Abb. 1, oben rechts) oder sekretorische Gewebe im Inneren des Blattes (Abb. 1, oben links) enthalten oft Stoffe mit abschreckender Wirkung gegenüber Pflanzenfressern (Herbivoren). Neben solchen Abwehrstoffen gehören auch viele farbige und geschmacksaktive chemische Verbindungen zu den sogenannten Sekundärstoffen oder, besser ausgedrückt, spezialisierten Naturstoffen. Der Farbreichtum von Blüten und der Geschmack von Nektar kommunizieren dagegen – analog dem Fähnchen auf dem höchsten Turm – die Absicht, Besucher anzulocken: Bei Blütenpflanzen sind Insekten oder Vögel das Ziel der Signale, um die Bestäubung zu sichern.
In ihrer Funktion als Abwehr- oder Signalstoffe bestimmen spezialisierte Naturstoffe die Stellung der produzierenden Organismen im ökosystemaren Gefüge der Arten. Sie besitzen deshalb eine enorme Bedeutung für die Produzenten und bestimmen, wie stark sich eine Art behauptet, ausbreitet oder zurückziehen muss – und dienen damit letztlich der Erhaltung und Verbreitung der Art.
Die chemische Struktur spezialisierter Naturstoffe ist oft einzigartig in der Natur. Sie sind häufig nur in wenigen Arten, einer einzigen Art, oder sogar nur in wenigen Zellen einer Art zu finden. Die Aufklärung der Struktur dieser Naturstoffe und die Bestimmung ihrer Konzentration sind eine Aufgabe der klassischen Naturstoffchemie und stellen heute in der Regel kein Problem mehr dar, wenn sie in ausreichender Menge zugänglich sind. Das Vorkommen in bestimmten Organen und Zellen, die Zusammensetzung des dort vorliegenden Stoffgemisches sowie seine zeitliche Änderung sind jedoch wegen der winzigen Mengen oft eine Herausforderung für die chemische Analytik.
Methoden zur Analyse von Naturstoffen im pflanzlichen Gewebe
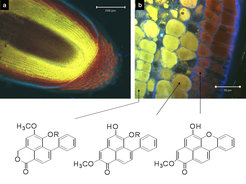
Herkömmlich wurden Naturstoffe im pflanzlichen Gewebe mit histochemischen Methoden unter dem Mikroskop sichtbar gemacht. Diesen Techniken liegen chemische Reaktionen mit Färbereagenzien zugrunde, die manchmal eine geringe Spezifität aufwiesen. Mit weiteren mikroskopischen Methoden, wie der Konfokalen Laser-Scanning-Mikroskopie (CSLM), der Multiphotonen-Fluoreszenz-Mikroskopie und der Mikrospektralen Photometrie (MSP), lassen sich bis zu einer methodenabhängigen Schichtdicke Einblicke in die 3-dimensionale Verteilung von fluoreszierenden oder UV-absorbierenden Stoffen im Gewebe erhalten. Stark absorbierende bzw. fluoreszierende Stoffe sind selektiv und zellspezifisch nachweisbar, wie am Beispiel von Phenylphenalenonen in Wurzelspitzen von Xiphidium caeruleum gezeigt werden konnte (Abb. 2) [1]. Die quantitative Detektion im Gemisch ist dagegen problematisch. In jüngerer Zeit entwickelte massenspektrometrische und Raman-spektroskopische Verfahren wurden erfolgreich zur Analyse von Naturstoffen auf Oberflächen und in einzelnen Zellen angewandt.
Magnetresonanz-Spektroskopie
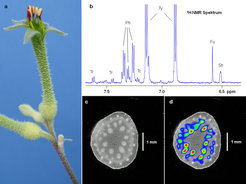
Die Magnetresonanz-Spektroskopie (engl.: Magnetic Resonance Spectroscopy, NMR), obwohl deutlich weniger empfindlich als z.B. die Massenspektrometrie, ist die wertvollste Methode zur Strukturanalyse, da sie die komplette Molekülstruktur, eingeschlossen die Unterscheidung von Isomeren, liefert, zerstörungsfrei arbeitet und sehr gut zur Quantifizierung geeignet ist. Bildgebende Magnetresonanz-Verfahren wurden in unserer Gruppe in Kombination mit hochauflösender 13C-NMR-Spektroskopie verwendet, um den Transport von Zuckern in pflanzlichen Leitbündeln sichtbar zu machen. In den mit Magnetresonanz-Methoden aufgenommenen Bildern in Abbildung 3 wird die Verteilung von Leitbündeln im Blütenstiel (Pedunkel) (Abb. 3c) sichtbar gemacht und die Beladung der Leitbündel mit 13C-markierten Zuckern nachgewiesen (Abb. 3d) [2]. Bevor sie das Nektarium erreichen, wird das Mischungsverhältnis der drei wichtigsten Zucker im Blütennektar auf den „Geschmack“ der Bestäuber eingestellt: Hexose-dominierte Nektare (viel Glucose und Fructose, wenig Saccharose), wie die der in Australien vorkommenden Anigozanthos-Arten, sind attraktiv für Singvögel. So können australische „Honigfresser“ mit ihren langen Schnäbeln den Nektar durch den gestreckten Blütenkelch erreichen. Die NMR-Spektroskopie wurde auch verwendet, um Spurenkomponenten (z.B. Aminosäuren und phenolische Verbindungen) im Metabolitengemisch von Nektarproben zu bestimmen (Abb. 3b) [3].
Laser-Mikrodissektion
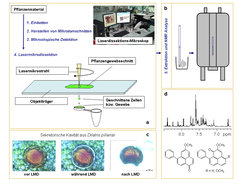
Um eine noch bessere örtliche Auflösung der Magnetresonanz-spektroskopischen Messungen zu erreichen, können Proben untersucht werden, die zuvor mit einem Laser aus dem Gewebe herausgeschnitten wurden [4]. Wichtige Voraussetzung für die Anwendung der Laser-Mikrodissektion (LMD) ist zunächst die zweifelsfreie Identifizierung der interessanten Zellen in den Gewebeschnitten. Die Fluoreszenz von Zellbestandteilen oder die Anordnung bzw. Form der Zellen dienen als Erkennungsmerkmale zum Setzen der Markierungslinien auf dem Display des Lasermikroskops. Das eigentliche Heraustrennen der Zellen erfolgt mit einem Computer-gesteuerten fokussierten Laserstrahl. Die isolierten Zellen oder Gewebestücke werden dann der NMR-Analyse zugeführt [5, 6] (Abb. 4), können aber auch mit anderen analytischen Methoden, z.B. Massenspektrometrie [7], vermessen werden.
LMD und NMR zur Zelltyp-spezifischen Analyse von spezialisierten Naturstoffen
Laser-Mikrodissektionen von sekretorischen Zellen aus dem Blattgewebe von Dilatris-Arten (Haemodoraceae), kombiniert mit NMR-Analysen, ergaben hohe Konzentrationen an Phenylphenalenonen [5]. Diese phenolischen Naturstoffe gelten als Abwehrstoffe gegenüber pilzlichen Erregern in einigen monokotylen Pflanzenfamilien, wie z. B. Haemodoraceae und Musaceae (Bananengewächse). Die Speicherung in sekretorischen Zellen im Blatt deutet auf eine zusätzliche Aktivität gegenüber Fraßfeinden hin. Zehn der relativ voluminösen sekretorischen Zellen waren ausreichend, um drei Phenylphenalenone zu identifizieren und die Mengenverhältnisse zu bestimmen.
Die Gemeine Fichte (Picea abies), der am weitesten verbreitete Nadelbaum in Nordeuropa und Sibirien, leidet häufig unter massivem Befall durch den Borkenkäfer (Ips typographus). Als Folge des Befalls durch den Käfer und einen assoziierten Pilz, Ceratocystis polonica, wird neben der Terpensynthese auch die Bildung phenolischer Abwehrstoffe angeschaltet. Spezielle parenchymatische Zellen sowie sogenannte Sklereiden („Steinzellen“) wurden in diesem Zusammenhang mithilfe der LMD aus der Borke isoliert und die entsprechenden Extrakte mit 1- und 2-dimensionalen NMR-Methoden analysiert [6]. Unter anderem wurde das Stilbenderivat Astringin identifiziert und die Konzentration in den ausgeschnittenen Zellen bestimmt. Weiterführende Untersuchungen sind im Institut in Arbeit.
Die Kombination von LMD und NMR wird in einem laufenden Projekt eingesetzt, um die räumliche und zeitliche Auflösung der Lignan-Biosynthese in speziellen Zellschichten der Hülle von Leinsamen (Linum usitatissimum) zu untersuchen. Lignane stellen einen „chemischen Schutzschild“ für die Leinsaat dar und sind für medizinische und nutrazeutische Anwendungen – als Bestandteil funktioneller Lebensmittel – interessant. Mit der Identifizierung der produzierenden Zellen lassen sich Blockadestellen im Stoffwechsel aufspüren und perspektivisch Wege finden, um die bisher nicht effektiv mögliche biotechnologische Herstellung von Lignanen wirtschaftlich zu gestalten.
Zukünftige Entwicklungen
Fortschritte in der instrumentellen Analytik, besonders der Massenspektrometrie und der Magnetresonanz-Spektroskopie, erlauben heute die Analyse der Metaboliten in Einzelzellen oder wenigen Zellen eines bestimmten Zelltyps. Der Aufwand, besonders zur Präparation der für die NMR erforderlichen Mengen, ist jedoch noch beträchtlich. Die weitere Entwicklung der Gerätetechnik und die damit zugänglich werdenden Analysemethoden werden in Zukunft immer geringere Substanzmengen für metabolomische Studien erfordern. Hochfeld-NMR-Spektrometer und die auf Hyperpolarisationsmethoden beruhende dramatische Empfindlichkeitssteigerung wird sowohl auf die hochauflösende NMR als auch auf bildgebende Magnetresonanz-Verfahren durchschlagen.


![Magnetresonanz-spektroskopische Analyse des Zuckertransports und der Nektarbildung in Anigozanthos flavidus (Haemodoraceae). (a) Blüte, (b) 1H NMR Spektrum (Ausschnitt) mit Signalen von Fumarsäure (Fu), Phenylalanin (Ph), Shikimisäure (Sh), Tryptophan (Tr), und Tyrosin (Ty) [3]. (c) Magnetresonanz-Image (Bruker Avance 400, Kryo-Probenkopf) der Verteilung von Leitbündeln im Pedunkel, 1H Spinecho-Messung (Auflösung 32 x 32 µm2, Schnittdicke 1 mm, Messzeit 4 min). (d) Bild (c) überlagert mit einem Magnetresonanz-Image (Falschfarbenbild) der Signale von C-1 von α-Glucose und der Glucoseeinheit von Saccharose, gemessen mit einer 1H-13C Kreuzpolarisierungs-Methode (Auflösung 156 x 156 µm2, Schnittdicke 5 mm, Messzeit 4 Std.). Die Signalintensität steigt von dunkelblau über hellblau, grün und gelb zu rot. Magnetresonanz-spektroskopische Analyse des Zuckertransports und der Nektarbildung in Anigozanthos flavidus (Haemodoraceae). (a) Blüte, (b) 1H NMR Sp](https://www.mpg.de/4775918/original-1326299212.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDc3NTkxOH0%3D--efac0fb8be57a3533413b9110aa6e218d8a6caa6)
![Kombination von Laser-Mikrodissektion (LMD) und NMR zur Zelltyp-spezifischen Analyse von Naturstoffen. (a) Arbeitsschritte zur Vorbereitung und Durchführung der LMD bis zur (b) NMR-Analyse, (c) Präparation einer sekretorischen Kavität von Dilatris pillansii als Beispiel einer LMD, (d) 1H NMR Spektrum des Extrakts aus zehn sekretorischen Zellen von D. pillansii mit den Strukturen der drei identifizierten Phenylphenalenone [5]. Kombination von Laser-Mikrodissektion (LMD) und NMR zur Zelltyp-spezifischen Analyse von Naturstoffen. (a) Arbeitsschritte zur Vorbereitung und Durchf](https://www.mpg.de/4775739/original-1326299221.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDc3NTczOX0%3D--6357fab3896e5996b2135d1db9cea93a8307e899)