Symbiotische Bakterien verteidigen Bienenwölfe
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für chemische Ökologie
Symbiosen sind allgegenwärtig und für das Überleben von Tieren und Pflanzen von größter Bedeutung. Eine Gruppe von Grabwespen, die Bienenwölfe, schließt einen erstaunlichen Verteidigungspakt mit Bakterien: Durch die Produktion eines Cocktails aus Antibiotika schützen die Symbionten den Wespen-Nachwuchs im unterirdischen Kokon gegen Schimmelpilze und Bakterien. Dafür bietet der Bienenwolf den Partnern in seinen Antennen freie Kost und Logis. Diese Symbiose ist bereits in der Kreidezeit entstanden und könnte eine Schlüsselanpassung für den evolutionären Erfolg der Bienenwölfe gewesen sein.
Evolutionäre Bedeutung von Symbiosen

Vor etwa zwei Milliarden Jahren nahm eine Vorläuferzelle der heute lebenden Tiere, Pflanzen und Pilze ein Bakterium auf, woraus sich im Laufe der Evolution die Energiekraftwerke unserer Zellen, die Mitochondrien, entwickelten. Ungefähr 500 Millionen Jahre später passierte noch einmal etwas Ähnliches mit einem phototrophen Cyanobakterium, aus dem die Chloroplasten entstanden, die den heute lebenden Pflanzen die Photosynthese ermöglichen. Derartige mutualistische Assoziationen scheinen also eine zentrale Rolle in der Evolution multizellulären Lebens zu spielen. Aber auch außerhalb eukaryotischer Zellen sind Symbiosen in der Natur allgegenwärtig: Die meisten Bäume und viele andere Pflanzen sind für die Nährstoffversorgung auf symbiotische Pilze oder Bakterien angewiesen. Tiere wiederum benötigen für eine funktionierende Verdauung eine ganz bestimmte Bakterien-Gemeinschaft im Darm. Und Flechten stellen sogar zu einem Organismus verwachsene Assoziationen zwischen Algen und Pilzen dar. Ohne Symbiosen könnte ein Großteil der Arten auf unserer Erde gar nicht überleben.
Auch Insekten sind mit einer Vielzahl nutzbringender Mikroben vergesellschaftet [1]. In den meisten Fällen stellen die Symbionten ihren Wirten wichtige Nährstoffe zur Verfügung, die diese selbst nicht produzieren oder in ausreichender Menge mit ihrer Nahrung aufnehmen können. Die Symbionten greifen damit in den Primärstoffwechsel ihrer Wirte ein und ermöglichen so die Erschließung neuer Nahrungsquellen. Aber auch über die Ernährung hinaus können symbiotische Mikroorganismen mit ihren erstaunlichen metabolischen Fähigkeiten maßgeblich zum Überleben ihrer Wirte beitragen. Eine überraschende Art der Symbiose findet sich beim Europäischen Bienenwolf (Philanthus triangulum), einer heimischen Grabwespenart.
Ein spezialisierter Bienenjäger
Bienenwölfe verdanken ihren außergewöhnlichen Namen der Tatsache, dass sie Honigbienen jagen und als Proviant für ihre Larven verwenden (Abb. 1). Die Bienen werden durch einen gezielten Stich in die Brust gelähmt und in unterirdische Brutkammern geschafft, wo sie der Bienenwolf-Larve als Nahrung dienen. Später spinnt sich die Larve in einen Kokon ein und überdauert die kalten Wintermonate im Boden, um dann im nächsten Sommer als erwachsener Bienenjäger aus dem Kokon zu schlüpfen und das Nest zu verlassen. Dabei ist die Larve der ständigen Gefahr von Infektionen durch Schimmelpilze und Bakterien ausgesetzt, deren Sporen im Boden sehr zahlreich vorkommen. Zum Schutz gegen diese schädlichen Keime verbündet sich der Bienenwolf mit Antibiotika produzierenden Bakterien [2].
Symbionten schützen den Bienenwolf-Nachwuchs
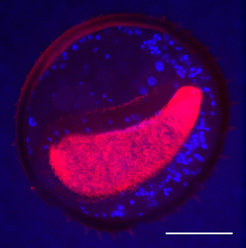
Die symbiotischen Mikroorganismen werden von weiblichen Bienenwölfen in hoch spezialisierten Drüsenreservoiren in den Antennen gezüchtet [2, 3] (Abb. 2). Diese Strukturen füllen einen großen Teil des Antennenvolumens aus und sind nach derzeitigem Kenntnisstand einzigartig im Tierreich. Schon lange und für viele Insekten erwiesen ist, dass durch Symbiosen mit Mikroorganismen neuartige Organe und Strukturen gebildet werden können [1]; die Kultivierung von Bakterien in den Fühlern von Insekten jedoch war bislang völlig unbekannt. Zur Versorgung der Bakterien in den antennalen Zuchtstätten dienen wahrscheinlich die umgebenden Drüsenzellen, die Nährstoffe in die Bakterienspeicher abgeben könnten. Außerdem deuten chemische Untersuchungen darauf hin, dass auch aus der Hämolymphe – dem offenen Blutkreislaufsystem der Insekten – Substanzen in die Symbionten-Kammern transportiert werden.
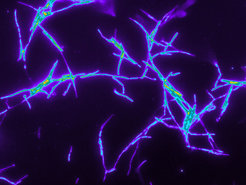
Aus seinen Fühlern gibt das Bienenwolfweibchen die Bakterien als ein weißliches Sekret in die unterirdische Brutkammer ab (Abb. 3). Erst danach legt es ein Ei auf eine der als Proviant für die Larve bereitgelegten Bienen. Nachdem sich die Larve satt gefressen hat, nimmt sie die Bakterien auf und spinnt sie in den Kokon mit ein, so dass die Symbionten schließlich eine durchgängige Schicht auf dem Kokon bilden [4]. Dort erfüllen sie eine überlebenswichtige Funktion: Sie schützen den Kokon und damit auch die Larve vor Pilzbefall. Wie wichtig die Bakterien tatsächlich für den Überlebenserfolg der Larve sind, zeigten Experimente in speziellen Beobachtungskästen: Werden die Symbionten aus den Brutkammern entfernt, sinkt die Überlebenswahrscheinlichkeit der Larven dramatisch von etwa 80 auf knapp 10 Prozent [2].
Antibiotische Kombinationsprophylaxe
Wie genau funktioniert der Schutz des Kokons durch die Bakterien? Untersuchungen der ribosomalen RNA der Bakterien, die wie ein genetischer Fingerabdruck die Identifizierung unbekannter Mikroben erlaubt, enttarnten die Symbionten als eine neue Art innerhalb der Gattung Streptomyces. Diese Gattung ist bekannt für die Produktion eines breiten Spektrums an antibiotischen Substanzen, unter anderem des Streptomycins, des ersten wirksamen Medikamentes gegen die gefürchtete Tuberkulose. Streptomyces-Arten produzieren nicht nur die meisten der medizinisch relevanten Antibiotika, sondern Schätzungen zufolge noch über 100000 weitere aktive Sekundärmetabolite, die noch auf ihre Entdeckung warten. Aufgrund dieses enormen Potenzials lag die Vermutung nahe, dass die Schutzfunktion der Bienenwolf-Symbionten ebenfalls durch Antibiotika vermittelt wird.
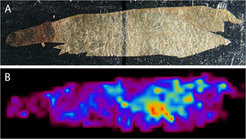
Tatsächlich ergaben chemische Analysen der Wespenkokons, dass die Bakterien einen ganzen Cocktail verschiedener Antibiotika produzieren. Die Kombination von Streptochlorin mit mindestens acht verschiedenen Piericidin-Derivaten hemmt das Wachstum eines breiten Spektrums von Schimmelpilzen und Bakterien [5]. Massenspektrometrische Untersuchungen zeigten hohe Antibiotika-Konzentrationen auf der Außenseite des Kokons, die die erste Verteidigungslinie der Wespenlarve darstellt (Abb. 4). Auf der Innenseite hingegen fehlen die Substanzen fast vollständig, was vermutlich das Auftreten unerwünschter Nebenwirkungen auf die Wespe selbst verhindert; denn die Piericidine sind auch für Insekten schädlich [5]. Obwohl die Antibiotika nur in den ersten zwei Wochen nach dem Spinnen des Kokons produziert werden, bieten sie einen effizienten Schutz für die Bienenwolflarve bis zum Schlupf aus dem Kokon, der erst bis zu neun Monate später stattfindet.
Evolution in der Kreidezeit
Innerhalb der Grabwespen (Crabronidae) umfasst die Gruppe der Bienenwölfe drei verschiedene Gattungen mit weltweit insgesamt etwa 170 Spezies, die unterschiedliche Bienen- und Wespenarten als Nahrung für ihre in unterirdischen Nestern lebenden Larven verwenden. Alle bislang untersuchten Arten weisen die symbiotischen Streptomyces-Bakterien in strukturell ähnlichen Antennendrüsen-Reservoiren auf, während nah verwandte Grabwespen weder die Symbionten noch die Reservoire zu besitzen scheinen [6-8]. Das deutet darauf hin, dass diese Symbiose nur einmal in dem Vorfahren aller rezenten Bienenwolfarten entstanden ist. Durch die Sequenzierung verschiedener Genabschnitte konnte ein Stammbaum der Bienenwölfe und ihrer nächsten Verwandten rekonstruiert werden, und die Kalibrierung mit fossilen Grabwespen aus Frankreich und den USA ermöglichte eine Datierung der evolutionären Vergangenheit dieser Gruppe. Erstaunlicherweise sind die Bienenwölfe – und damit auch die schützende Symbiose mit Bakterien – bereits über 60 Millionen Jahre alt, ihr Ursprung reicht bis in die Kreidezeit zurück.
Die Allianz der Bienenwölfe mit Antibiotika produzierenden Symbionten stellt eine elegante Methode dar, die bereits vorhandenen metabolischen Kapazitäten von Bakterien für die eigene Abwehr gegen Infektionen zu nutzen. Da auch die Symbionten von der Assoziation profitieren, nämlich durch die gesicherte Nährstoffversorgung in den Antennen und eine zuverlässige Weitergabe an die nächste Wirtsgeneration, könnte sich eine solche Symbiose, sobald entstanden, schnell etabliert haben. Blattschneiderameisen und Borkenkäfer sind weitere Beispiele, bei denen Symbionten zwar nicht den Nachwuchs, wohl aber die Nahrungsressourcen der Wirte schützen. Es könnte also durchaus sein, dass ähnliche Verteidigungsallianzen im Tierreich weit verbreitet sind. Jedenfalls zeigt das Beispiel des Bienenwolfes, dass der gezielte Einsatz einer Kombination von Antibiotika auch über Millionen von Jahren hinweg einen effizienten Schutz bieten kann. Ein Erfolg, der uns Menschen zu denken geben sollte: Denn uns gehen schon jetzt, lediglich knapp 100 Jahre nach der Entdeckung des Penicillins, durch den oft bedenkenlosen Einsatz von Antibiotika die wirksamen Medikamente im Kampf gegen zunehmend resistente Krankheitserreger aus.



![Abb. 4: Verteilung der Antibiotika auf der Oberfläche eines Bienenwolfkokons (Philanthus triangulum). (A) Fotografie des Kokons auf einer MALDI-Platte für die bildgebende Massenspektrometrie (LDI-TOF/MS-imaging). (B) Messung des Antibiotikums Piericidin A1 anhand eines charakteristischen Ions [m/z 454 ± 0.5 [M+K]+]. Warme Farben bedeuten hohe, kalte Farben niedrige Konzentrationen. Abb. 4: Verteilung der Antibiotika auf der Oberfläche eines Bienenwolfkokons (Philanthus triangulum). (A) Fotografie des Kokons auf einer MALDI-Platte](https://www.mpg.de/11588844/original-1663070865.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE1ODg4NDR9--92d90f8fada90535dc617c4e9c65b8548cf9c5af)