Die Bildung von Terpenpheromonen in Blattkäfern
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für chemische Ökologie
Einführung
Eine grundlegende Fähigkeit von Lebewesen besteht darin, mit Artgenossen zu kommunizieren, um nützliche Informationen auszutauschen. Obwohl für uns Menschen und auch einige Tiere die akustische und visuelle Verständigung dabei im Vordergrund zu stehen scheint, kommunizieren die meisten Organismen auf chemischem Wege miteinander. Sogenannte Pheromone spielen für diese Kommunikation als Botenstoffe eine wichtige Rolle. Man definiert sie als chemische Verbindungen, die von einem Individuum abgegeben werden und in einem anderen Individuum der gleichen Art eine spezifische Reaktion hervorrufen. In Insekten ist bereits ein ganzes Arsenal solcher Pheromone sowie ihre Wirkung erforscht und beschrieben worden. So nutzen Insekten Pheromone unter anderem dazu, einen Geschlechtspartner zu finden (Sexualpheromone), Artgenossen zu einer ergiebigen Futterquelle zu locken (Aggregationspheromone), vor Feinden zu warnen (Alarmpheromone) oder eine Spur vom Nest zur Futterquelle zu markieren (Spurpheromone) [1]. Chemisch betrachtet handelt es sich bei Insektenpheromonen häufig um Fettsäuren bzw. deren Derivate, längerkettige Alkohole und Aldehyde sowie Terpene und terpenoide Verbindungen (Abb. 1). Das Wissen um diese Stoffe ermöglicht es, künstlich hergestellte Pheromone in Pheromonfallen einzusetzen, um Schadinsekten auf land- und forstwirtschaftlich genutzten Flächen ganz spezifisch und sehr effizient zu fangen. Die komplizierte chemische Struktur vieler Pheromone erschwert jedoch häufig ihre synthetische Herstellung und damit eine breitere Anwendung im Pflanzenschutz.
Terpene als Aggregationspheromone in Flohkäfern
Die zu den Blattkäfern gehörenden Flohkäfer der Gattungen Phyllotreta und Psylliodes sind bedeutende Pflanzenschädlinge, die vorwiegend Raps und Kohl sowie andere Kreuzblütengewächse befallen und weltweit erhebliche Ertragseinbußen verursachen. Die Käfer treten häufig in großer Anzahl auf und können dadurch innerhalb kürzester Zeit ganze Pflanzen bzw. Felder entlauben. Für die zeitverzögert auf den Fraß einsetzende Abwehrreaktion der Pflanze kommt der Befall zu massiv und schnell: Die Käfer fressen sie praktisch auf, bevor sie sich wehren kann. Das Massenauftreten wird durch Aggregationspheromone ausgelöst, die von fressenden männlichen Käfern abgegeben werden und andere Artgenossen zur Futterpflanze locken. Kürzlich konnte gezeigt werden, dass ausgewachsene männliche Kohlerdfloh-Käfer (Phyllotreta striolata) ein flüchtiges Terpengemisch produzieren, welches aus acht strukturell miteinander verwandten bizyklischen Sesquiterpenen besteht [2, 3]. Experimente offenbarten für zwei dieser Sesquiterpenverbindungen, dem (6R,7S)-Himachala-9,11-dien und dem (3S,9R,9aS)-3-Hydroxy-3,5,5,9-tetramethyl-5,6,7,8,9,9a-hexahydro-1H-benzo[7]annulen-2(3H)-on (Abb.1), eine Funktion als Aggregationspheromon in dieser Käferart.
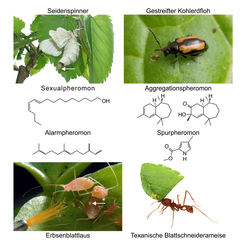
Abb. 1: Im Jahr 1959 wurde von Adolf Butenandt das erste Insektenpheromon - das Sexualpheromon des Seidenspinners Bombyx mori - chemisch identifiziert. Die Weibchen geben das Fettsäurederivat (E,Z)-10,12-Hexadecadienol (Bombykol) aus Duftdrüsen am Hinterleib ab (siehe Pfeil) und locken damit die Männchen zur Paarung an. Die Erbsenblattlaus Acyrthosiphon pisum produziert das lineare Sesquiterpen (E)-β-Farnesen als Alarmpheromon. Dieses ist Bestandteil eines Tropfens (siehe Pfeil), welcher aus den Siphunculi abgegeben wird, wenn eine Blattlaus von einem Räuber attackiert wird. Männliche Phyllotreta striolata Kohlerdflöhe geben während des Fressens eine Mischung verschiedener zyklischer Sesquiterpene ab. Die Sesquiterpene (6R,7S)-Himachala-9,11-dien (links) und (3S,9R,9aS)-3-Hydroxy-3,5,5,9-tetramethyl-5,6,7,8,9,9a-hexahydro-1H-benzo[7]annulen-2(3H)-on (rechts) bilden das Aggregationspheromon dieser Art, welches sowohl Männchen als auch Weibchen anlockt. Die Arbeiterinnen der Texanischen Blattschneiderameise Atta texana markieren den Weg von einer Futterquelle zum Nest mit dem Spurpheromon Methyl 4-methylpyrrol-2-carboxylat.
Die Biosynthese von Terpenen
Terpene sind eine evolutionär sehr alte und damit in vielen Lebewesen vorkommende Klasse von Naturstoffen. Sie leiten sich formal vom Isopren ab, einem Olefin mit fünf Kohlenstoffatomen. Die Klassifizierung der Terpene erfolgt in der Regel nach der Anzahl der Isopreneinheiten im Grundgerüst: Hemiterpene sind aus fünf Kohlenstoffatomen aufgebaut, Monoterpene besitzen 10, Sesquiterpene 15, Diterpene 20, Triterpene 30 und Tetraterpene 40 Kohlenstoffatome. Die Verknüpfung der Isopreneinheiten zu Isoprenyldiphosphaten, den eigentlichen Terpenvorstufen, wird durch Isoprenyldiphosphatsynthasen (IDS) katalysiert. Diese Enzyme bestimmen durch ihre Spezifität die Länge der Terpenkette. Terpensynthasen (TPS) wandeln schließlich die verschiedenen Isoprenyldiphosphate in die einzelnen zyklischen oder azyklischen Terpengrundgerüste um (Abb. 2). Während IDS-Enzyme bereits aus einer Vielzahl an Lebensformen wie Bakterien, Pilzen, Pflanzen, Insekten und höheren Tieren isoliert werden konnten, wurden Terpensynthasen bisher nur in Bakterien, Pilzen und Pflanzen gefunden [4]. Sequenzvergleiche lassen vermuten, dass alle bis jetzt beschriebenen TPS einen gemeinsamen, wahrscheinlich bakteriellen, Vorläufer besitzen, der aus einer IDS entstanden sein könnte.
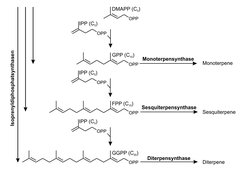
Abb. 2: Biosynthese von Terpenen. Die langkettigen Substrate der Terpensynthasen werden durch die schrittweise Verknüpfung von Dimethylallyldiphosphat (DMAPP) und Isopentenyldiphosphat (IPP) von Isoprenyldiphosphatsynthasen hergestellt.
Flohkäfer enthalten ungewöhnliche Terpensynthasen
Obwohl Flohkäfer wie P. striolata komplexe Sesquiterpengemische produzieren, scheinen sie keine Proteine mit Sequenzähnlichkeiten zu Terpensynthasen aus Bakterien, Pilzen oder Pflanzen zu besitzen. Eine Transkriptomsequenzierung offenbarte jedoch, dass P. striolata neun verschiedene Gene enthält, die Ähnlichkeiten zu IDS-Genen aufweisen [5]. Drei dieser Gene zeigen die typischen Merkmale von IDS-Genen aus anderen Insekten. Die biochemische Charakterisierung der entsprechenden Proteine ergab, dass zwei Kandidaten tatsächlich als IDS aktiv sind und die Substrate Isopentenyldiphosphat (IPP) und Dimethylallyldiphosphat (DMAPP) in die Sesquiterpenvorstufe Farnesyldiphosphat (FPP) umwandeln können. Die anderen sechs IDS-ähnlichen Gene weisen auffallende Unterschiede zu bekannten IDS auf und formen eine gut abgegrenzte Untergruppe innerhalb des Stammbaumes der Insekten-IDS (Abb. 3).
Experimente offenbarten, dass die entsprechenden Proteine zwar keine Aktivität als IDS besitzen, vier von ihnen jedoch FPP als Substrat akzeptieren und verschiedene Sesquiterpene produzieren [5]. Die Entdeckung dieser neuartigen Sesquiterpensynthasen in P. striolata und anderen verwandten Käferarten zeigt, dass die Evolution der Terpensynthasen in Flohkäfern unabhängig von der TPS-Evolution in anderen Organismen erfolgt sein muss. Vermutlich kam es in einem Vorfahren der Flohkäfer durch Genverdopplungen zu einer Erweiterung der IDS-Genfamilie. Einige der neuen IDS-Gene konnten nun Mutationen akkumulieren, welche letztlich zur Herausbildung der neuen Enzymfunktion und damit zur Entstehung einer neuen TPS-Familie führten.
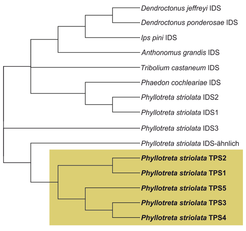
Abb. 3: Stammbaum von Isoprenyldiphosphatsynthasen (IDS) und Terpensynthasen (TPS) des Kohlerdflohs Phyllotreta striolata und anderen Käferarten.
Die Terpensynthase PsTPS1 katalysiert den Schlüsselschritt in der Bildung des Aggregationspheromons im Kohlerdfloh P. striolata
Die biochemische Untersuchung der vier aktiven in P. striolata gefundenen Terpensynthasen PsTPS1-4 ergab, dass eine von ihnen, PsTPS1, sowohl (6R,7S)-Himachala-9,11-dien als auch weitere der von männlichen P. striolata-Käfern abgegebenen Terpenverbindungen produziert [5]. Da außerdem das Gen PsTPS1 in männlichen Käfern stärker exprimiert wird als in weiblichen Käfern, lag die Vermutung nahe, dass PsTPS1 für die Sesquiterpenpheromonbildung in P. striolata verantwortlich ist. Tatsächlich zeigten männliche Käfer, in denen die Expression von PsTPS1 künstlich verringert war, eine verminderte Sesquiterpen-Produktion. Zwei weitere vom Käfer abgegebene, aber nicht direkt über PsTPS1 gebildete Pheromonverbindungen werden vermutlich aus (6R,7S)-Himachala-9,11-dien über noch nicht bekannte oxidierende Enzyme synthetisiert. Die Produkte der Terpensynthasen PsTPS2 - PsTPS24 konnten bisher nicht im Duft der Käfer nachgewiesen werden. Eventuell erfolgt ihre Bildung in anderen Entwicklungsstadien oder sie werden durch nachgeschaltete Enzyme in nicht-flüchtige Verbindungen umgewandelt.
Ausblick
Von männlichen Käfern abgegebene Aggregationspheromone verschiedener Flohkäfer-Arten dirigieren das massenhafte Auftreten dieser Insekten und somit ihr Schadpotential. Ein lokaler Einsatz von Pheromonfallen, mit denen die Käfer spezifisch angelockt und gefangen werden, würde die natürliche Population dieser Schadinsekten im Feld vermindern und somit die landwirtschaftlichen Schäden reduzieren. Da die Synthese von (6R,7S)-Himachala-9,11-dien und anderer strukturell verwandter Pheromone sehr aufwändig und teuer ist, könnte PsTPS1 genutzt werden, um diese Verbindungen auf biotechnologischem Wege herzustellen. Darüber hinaus können zukünftige Forschungen zur Pheromonbiosynthese und ihrer Regulation dazu beitragen, neuartige Strategien zu entwickeln, mit deren Hilfe diese Pflanzenschädlinge besser kontrolliert werden können.
![Abb. 1: Im Jahr 1959 wurde von Adolf Butenandt das erste Insektenpheromon - das Sexualpheromon des Seidenspinners Bombyx mori - chemisch identifiziert. Die Weibchen geben das Fettsäurederivat (E,Z)-10,12-Hexadecadienol (Bombykol) aus Duftdrüsen am Hinterleib ab (siehe Pfeil) und locken damit die Männchen zur Paarung an. Die Erbsenblattlaus Acyrthosiphon pisum produziert das lineare Sesquiterpen (E)-β-Farnesen als Alarmpheromon. Dieses ist Bestandteil eines Tropfens (siehe Pfeil), welcher aus den Siphunculi abgegeben wird, wenn eine Blattlaus von einem Räuber attackiert wird. Männliche Phyllotreta striolata Kohlerdflöhe geben während des Fressens eine Mischung verschiedener zyklischer Sesquiterpene ab. Die Sesquiterpene (6R,7S)-Himachala-9,11-dien (links) und (3S,9R,9aS)-3-Hydroxy-3,5,5,9-tetramethyl-5,6,7,8,9,9a-hexahydro-1H-benzo[7]annulen-2(3H)-on (rechts) bilden das Aggregationspheromon dieser Art, welches sowohl Männchen als auch Weibchen anlockt. Die Arbeiterinnen der Texanischen Blattschneiderameise Atta texana markieren den Weg von einer Futterquelle zum Nest mit dem Spurpheromon Methyl 4-methylpyrrol-2-carboxylat. Abb. 1: Im Jahr 1959 wurde von Adolf Butenandt das erste Insektenpheromon - das Sexualpheromon des Seidenspinners Bombyx mori - chemisch identifiziert](https://www.mpg.de/11633470/original-1508158418.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MzM0NzB9--d685867b55b0dae9fec59760716f9dce1d2e6d93)

